当发生严重骨缺损时,患者的活动受限并伴有信号传导延迟和骨生成障碍。本文设计了一种基于超声波驱动的压电支架的声动力疗法,旨在恢复细胞连接以促进再生。
成都奥创生物参与了名为《Ultrasound-Driven Piezoelectric Strategy and Performance:Polyurethane-Based Functioning Networks in Actuating Bone Repair》的实验项目,这项研究构建构建了聚氨酯(PU)基复合支架(掺入羟基磷灰石/钛酸钡,CHA/BaTiO3),为骨修复提供了一种有前景的修复平台。
Smart zwitterionic coatings with precise pH-responsive antibacterial functions for bone implants to combat bacterial infections
文章名:
Ultrasound-Driven Piezoelectric Strategy and Performance:Polyurethane-Based Functioning Networks in Actuating Bone Repair(超声驱动压电策略与性能:聚氨酯基功能网络在骨修复中的调控作用)
Advanced Functional Materials ( IF 18.5 ) Pub Date : 2025-05-05
DOI: 10.1002/adfm.202502684
挂名引用:
在骨重建过程中,物理信息发挥着重要作用,它能帮助我们更好地理解细胞信号传导和相关事件。机械应力作用于骨骼时,可产生内源性电场,电信号、机械信号和生化信号之间相互耦合,共同调节细胞的活动。在临床实践中,患者因某些原因导致活动受限时,新骨形成会受到影响。而压电生物材料具有独特的性能,能够实现机械信号和电信号的相互转换,这为骨疾病的治疗提供了新的思路。将低强度脉冲超声(LIPUS)与压电植入物相结合,在骨疾病治疗方面展现出了一定的应用潜力。
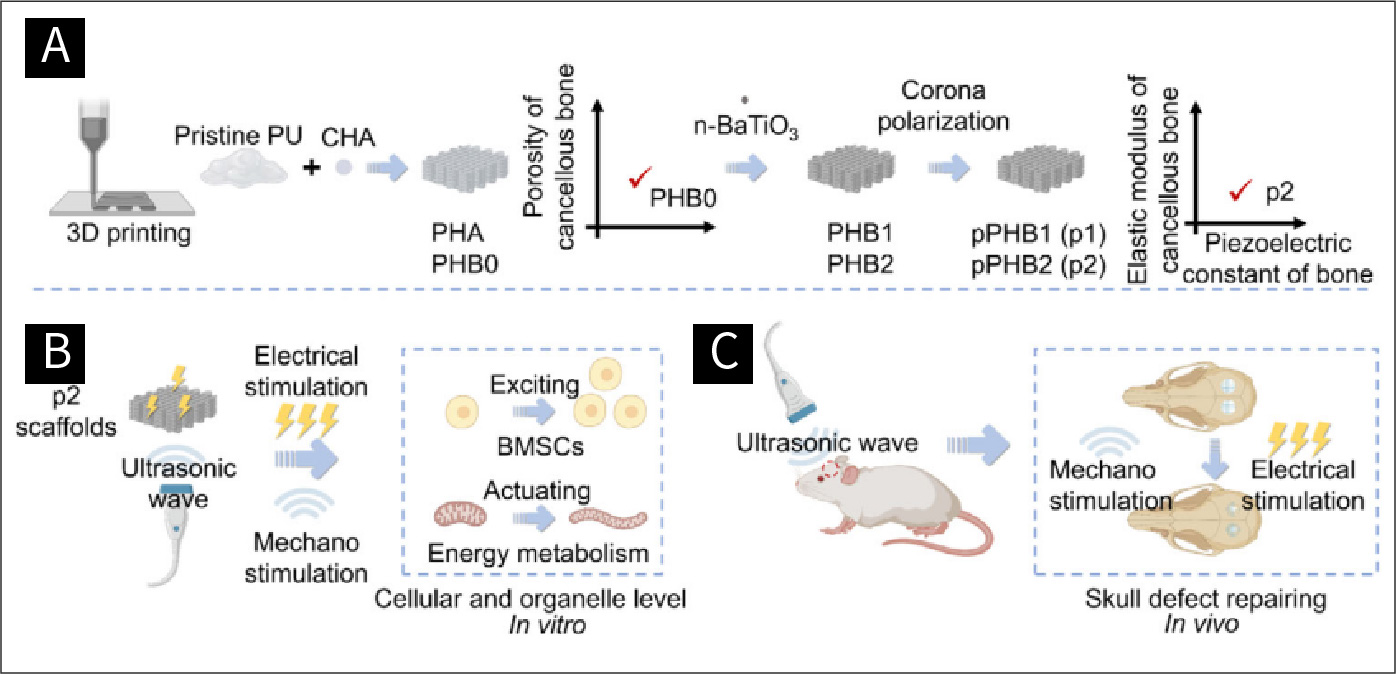
研究团队构建了一种基于超声驱动的压电支架的声动力学疗法旨在恢复细胞连接以进行再生。使用不同的聚氨酯基复合材料(羟基磷灰石/BaTiO3)制造一系列 3D 打印支架,并进一步极化以实现高压电常数。在低强度脉冲超声 (LIPUS) 的驱动下,来自极化支架的电信号得到优化,由于互连的压电相,实现了更高的开路电压 (197 mV)。超声驱动的压电线索提高了骨髓间充质干细胞 (BMSC) 中的胞质和线粒体钙水平,其中钙离子充当关键的第二信使,加强线粒体能量代谢和激发细胞活性。对大鼠颅骨缺损应用声动力学治疗后,钙信号通路、氧化磷酸化和柠檬酸循环通过功能网络在能量代谢中受到驱动,而血管生成的 HIF-1 信号通路以及成骨的 AMPK 和 MAPK 信号通路共同改善。优化的声动力学疗法促进了 ≈27.85% 的成骨 (8 W) 和缺损的早期新生血管形成 (4 W)。鉴于压电转导网络的高效率,声动力疗法提供持续的线粒体兴奋治疗以维持骨活力。
图一 声动力疗法及体内外实验示意:
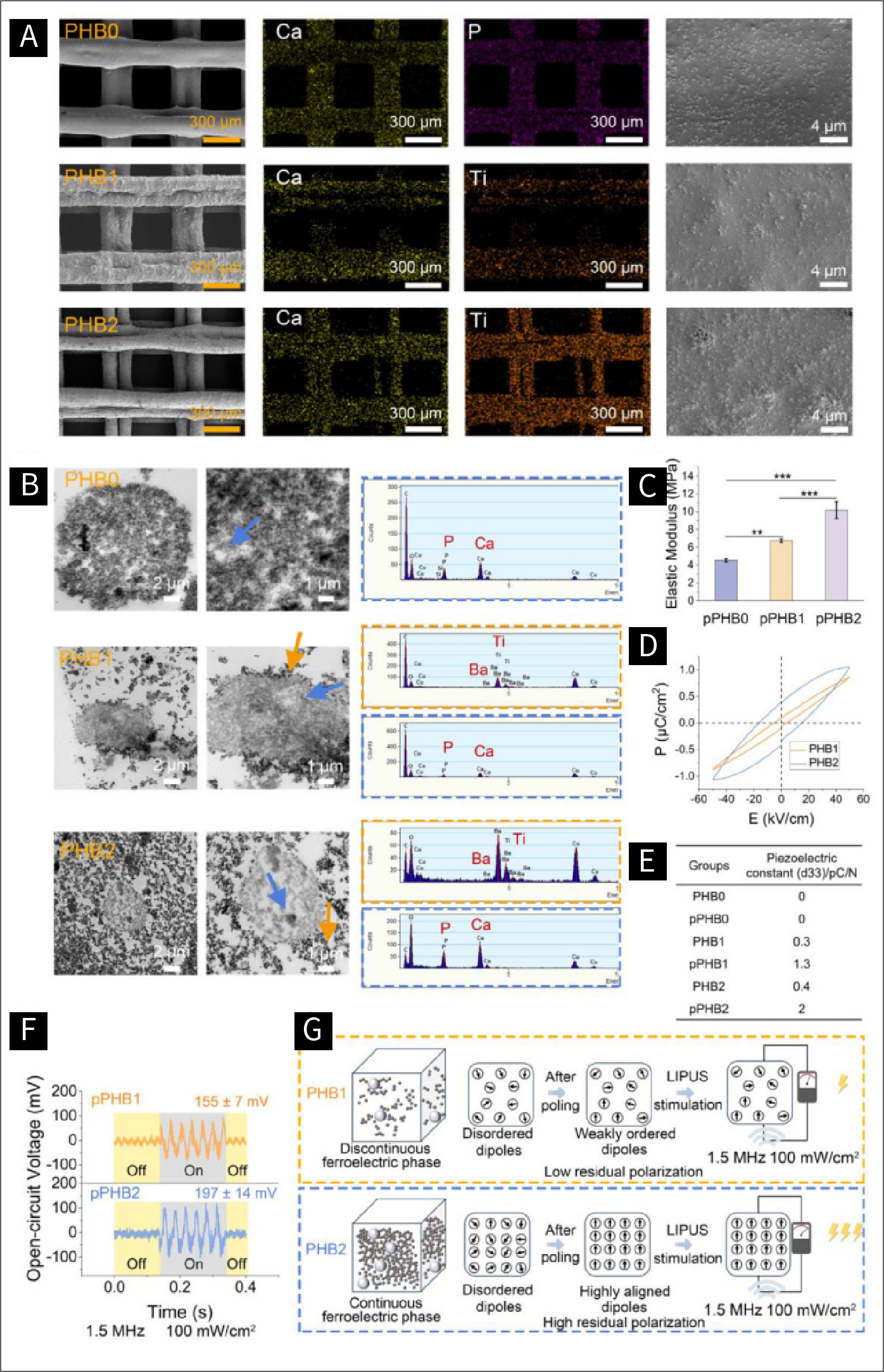
图二:
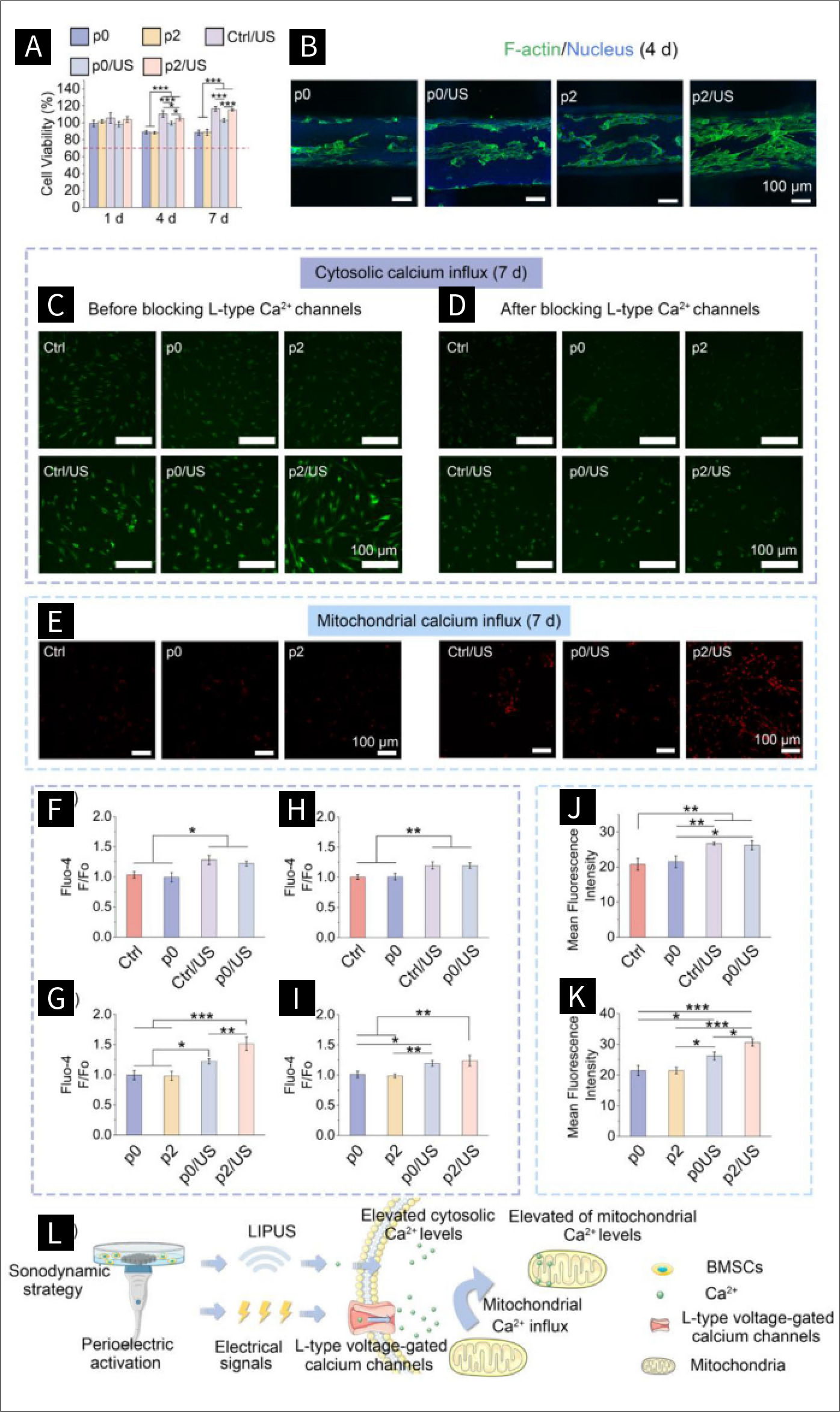
图三 超声波诱导的压电刺激对细胞活动的影响:
图3展示了在不同支架上培养的BMSCs(骨髓间充质干细胞)的细胞行为,包括有无LIPUS(低强度脉冲超声)的情况。A)通过CCK-8测定法测量了BMSCs的增殖情况(n = 5)。红色虚线表示70%的细胞存活率。B)显示了培养4天的BMSCs的合并荧光图像。绿色代表F-肌动蛋白,蓝色代表细胞核。在使用维拉帕米抑制L型钙通道之前,培养7天的BMSCs的胞质Ca2+荧光图像(C)及其相对荧光强度(F/Fo)的定量分析(F&G)(n=3)。在抑制L型电压门控钙通道后,培养7天的BMSCs的胞质Ca2+荧光图像(D)及其相对荧光强度(F/Fo)的定量分析(H&I)(n=3)。培养7天的BMSCs的线粒体Ca2+荧光图像(E)及其线粒体Ca2+荧光强度的定量分析(J&K)(n=3)。L)描述了通过声动力策略激活细胞Ca2+流入和线粒体Ca2+流入的示意图。
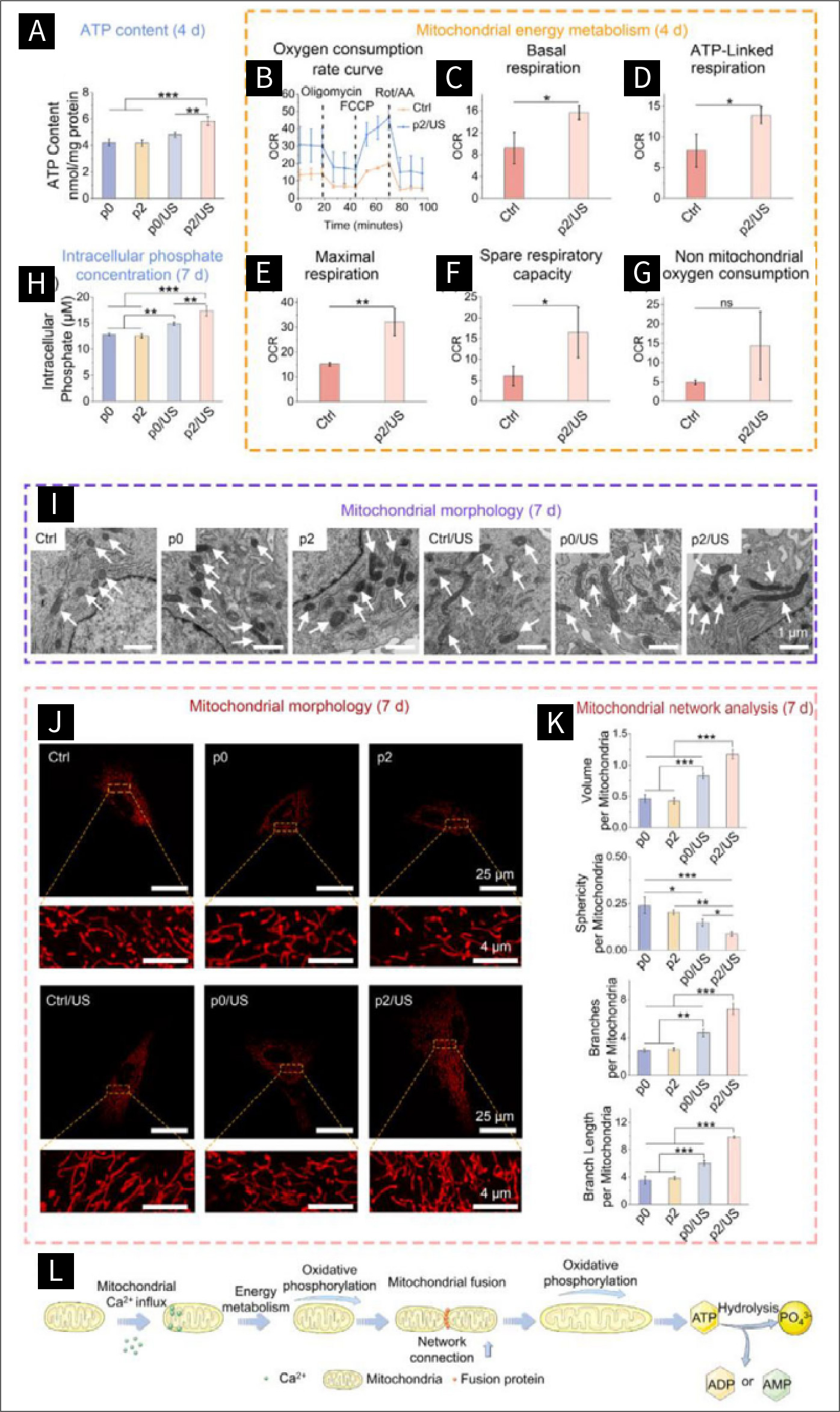
图四 超声波诱导的压电刺激对线粒体生物发生的影响:
图4。通过声动力策略调节的骨髓间充质干细胞(BMSCs)的能量代谢和线粒体形态。A)第4天BMSCs的ATP含量(n = 3)。B)第4天BMSCs的OCR曲线(n = 3),OCR单位为pmol/min/10000细胞。根据OCR曲线对C)基础呼吸、D)ATP相关呼吸、E)最大呼吸、F)余量呼吸能力和G)非线粒体耗氧量进行量化分析(n = 3)。H)第7天BMSCs的细胞内磷酸盐浓度(n = 3)。I)第7天BMSCs的线粒体形态。白色箭头指示线粒体。J)第7天BMSCs的线粒体形态和K)线粒体网络分析(n = 3)。L)声动力疗法促进BMSCs能量代谢的示意图。
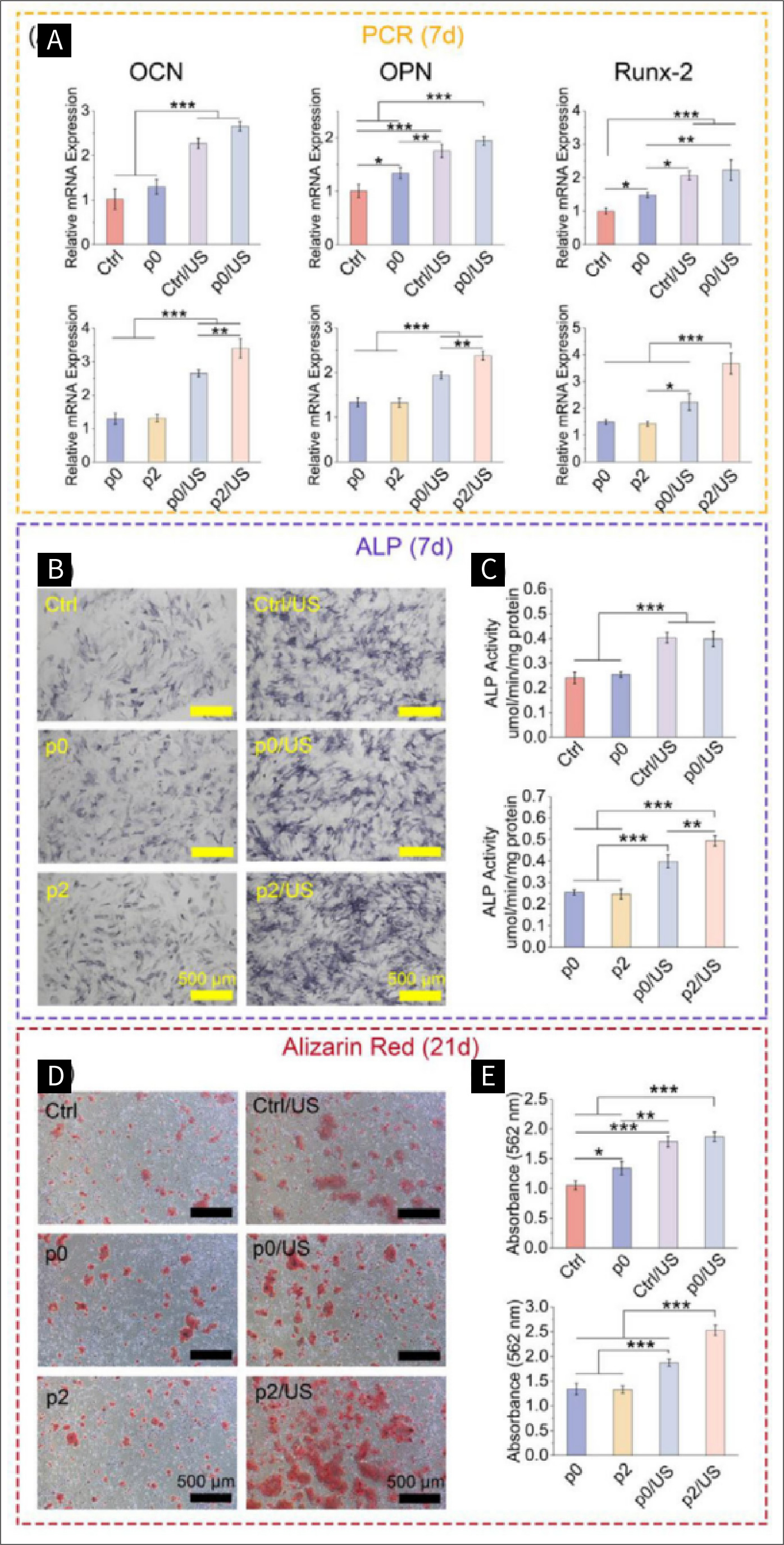
图五 超声诱导的压电刺激对成骨分化的影响:
图5。骨源性分化由声动力疗法调控的骨髓间充质干细胞。A)第7天(n = 3)氰酸盐、OPN和Runx-2的RT-qPCR结果。B)第7天ALP染色图像及C)ALP活性的定量分析(n = 3)。D)第21天茜素红染色图像及E)茜素红染色的定量分析(n = 3)。
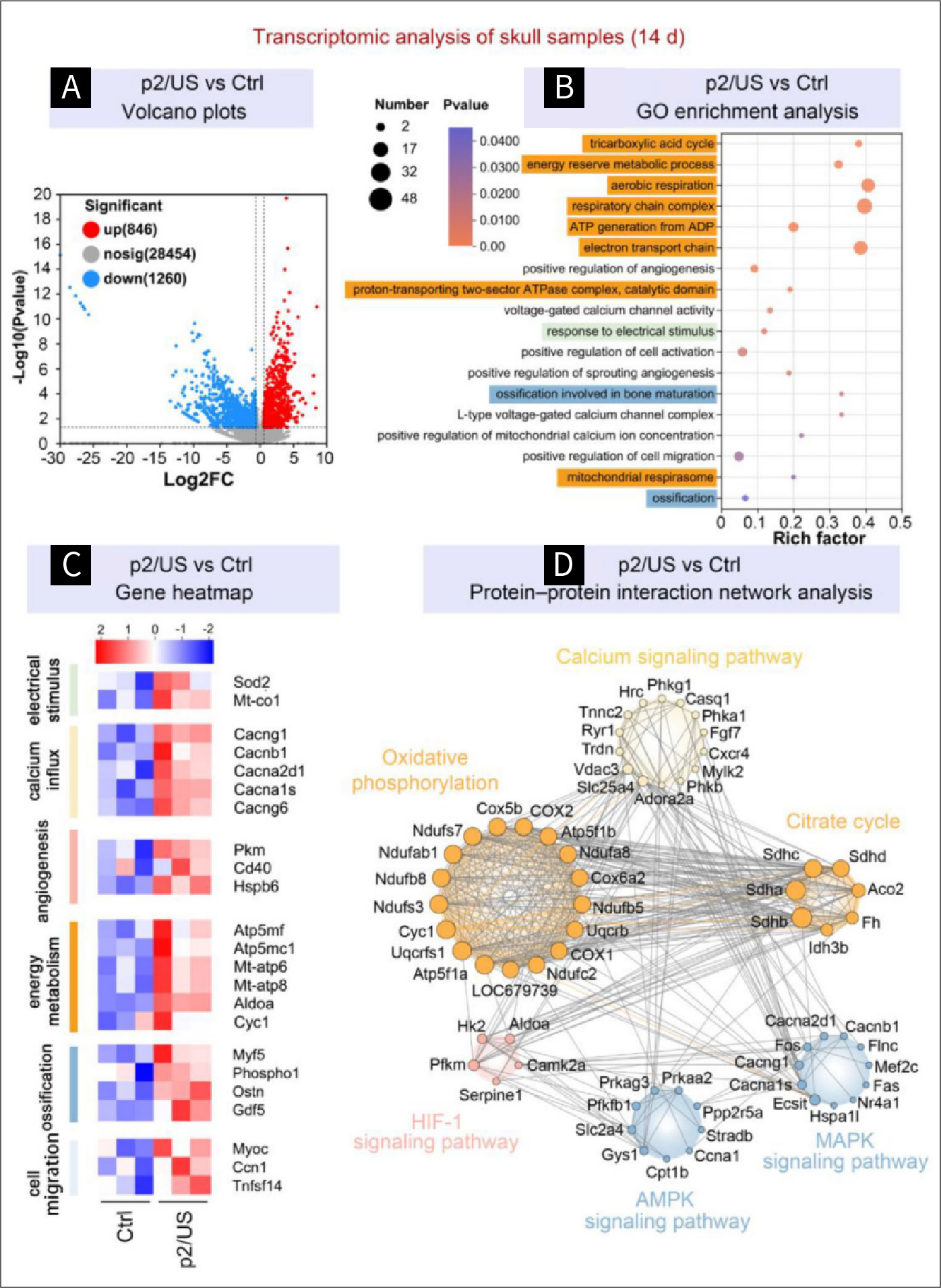
图六 超声波诱导的压电刺激对体内转录组学的影响:
图6.第14天颅骨样本的转录组分析。A)p2/US与对照组的火山图。B)p2/US与对照组中上调基因显著富集的基因(GO)。C)与电刺激正向调节、钙内流、血管生成、能量代谢、骨化和细胞迁移相关的基因。红色表示上调基因表达,蓝色表示下调基因表达。D)上调差异表达基因的蛋白质-蛋白质相互作用网络分析。
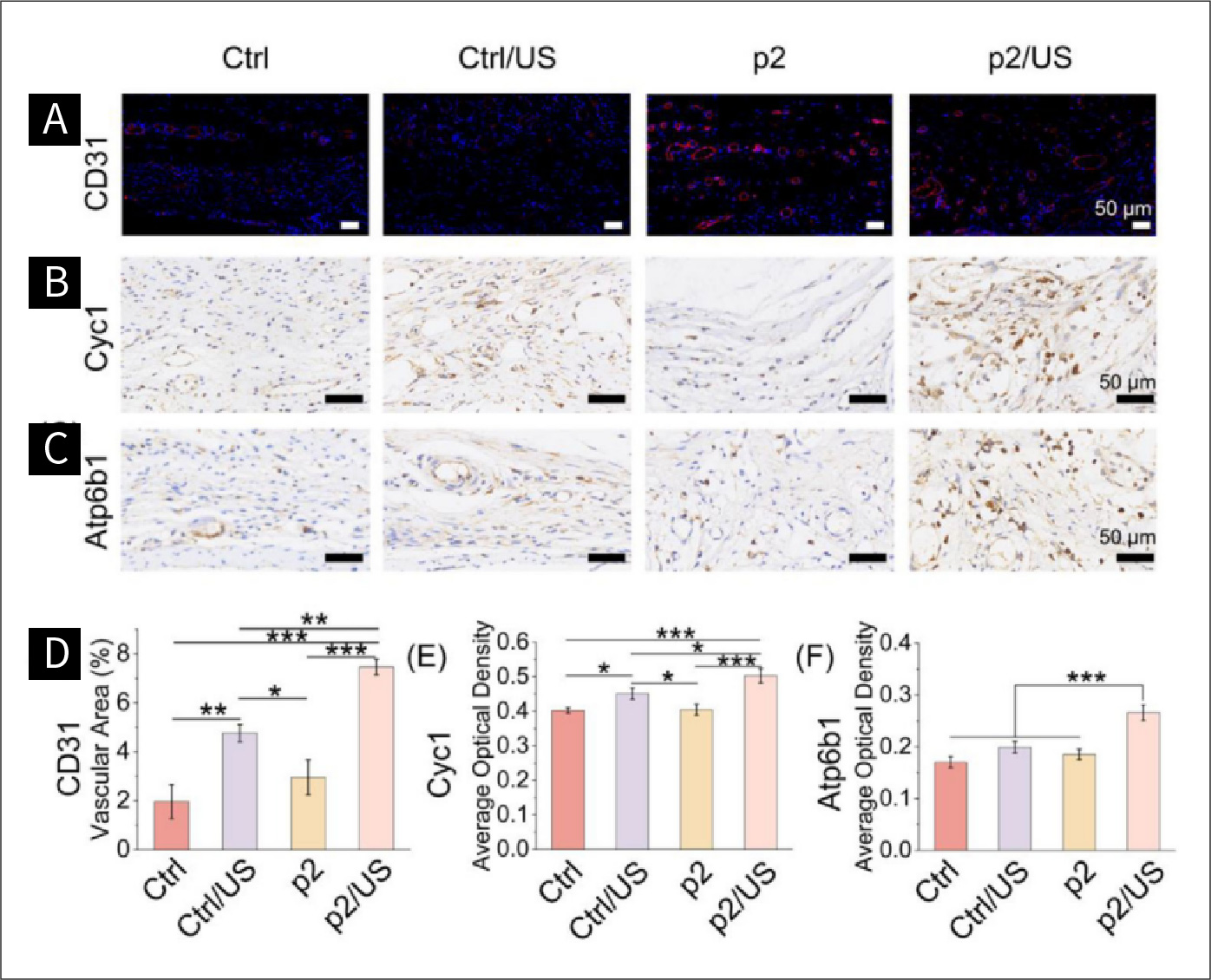
图七 超声波引起的压电刺激对缺陷修复的影响
图7.大鼠术后第4周颅骨缺损区域的血管生成和线粒体能量代谢。A)通过免疫荧光染色检测血管生成标志物(CD 31,蓝色代表DAPI,红色代表 CD31);D)血管面积的半定量结果(n = 3)。B)通过免疫组化染色检测ATP生成的标志物Cyc1;E)Cyc1的半定量结果(n = 3)。C)通过免疫组化染色检测ATP水解的标志物Atp6b1;F)Atp6b1的半定量结果。
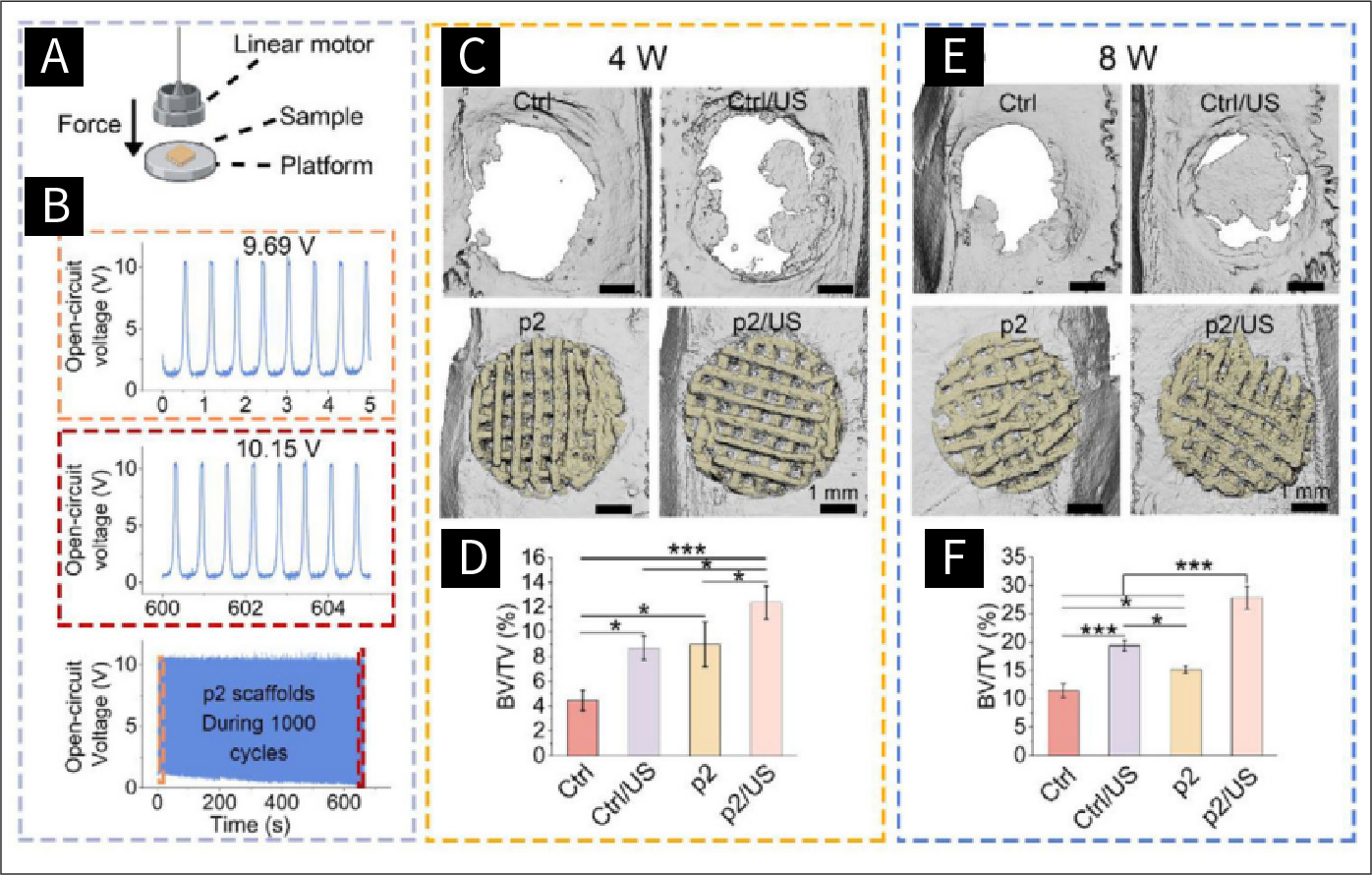
图八 声动力疗法诱导的大鼠颅骨缺损体内成骨评估
图8.A)压电测试装置在外部载荷(10 N,1.5 Hz)下的示意图。B)p2支架在1000个工作循环中的压电稳定性。缺陷区域(白色)和支架(黄色)的微CT重建图像分别在第4周(C)和第8周(E)。第4周(D)和第8周(F)的骨体积/总体积(BV/TV)定量统计分析(n = 3)。
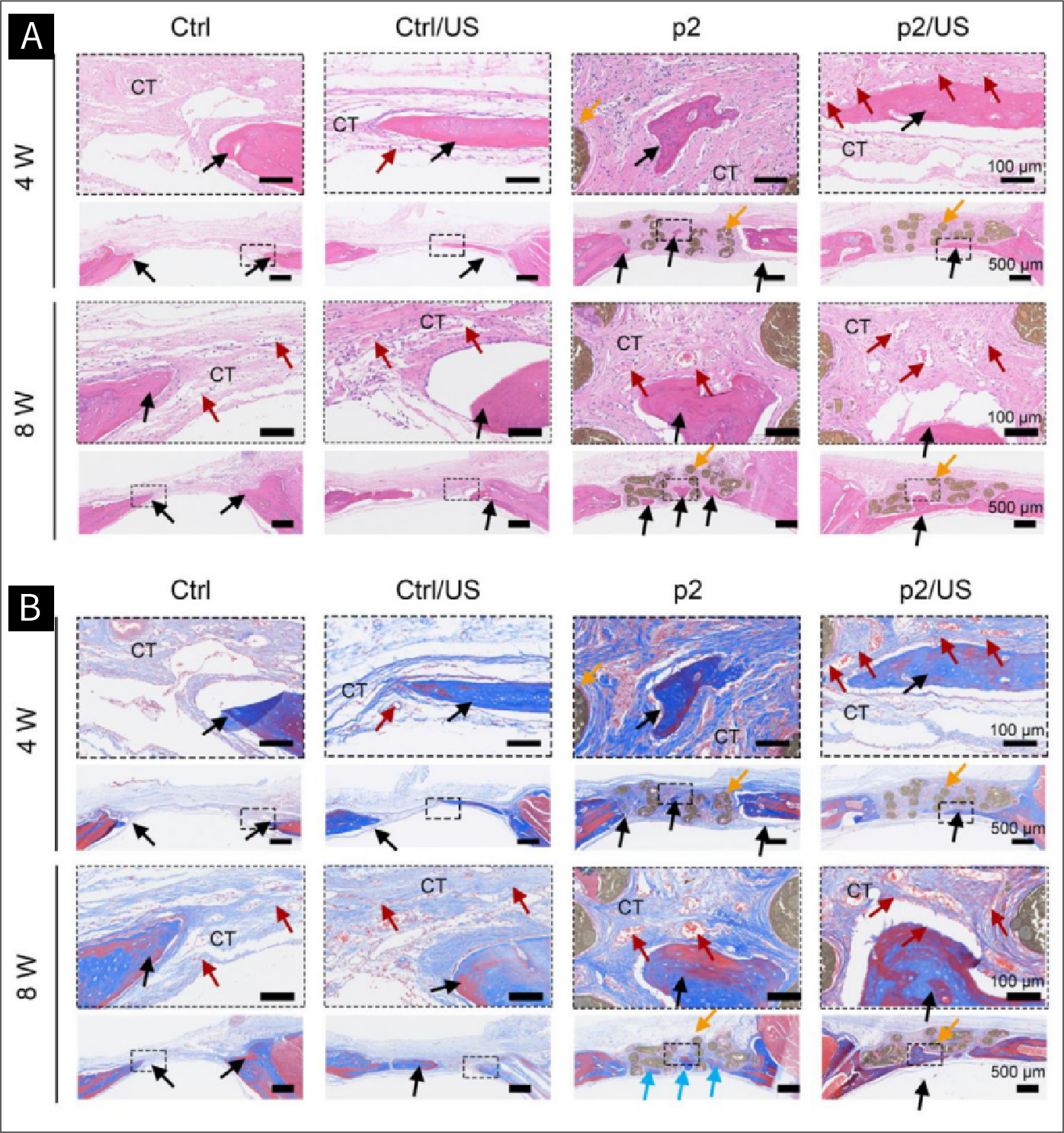
图九 大鼠颅骨缺损区域的组织形态学评估
图9.大鼠颅骨缺损区域的组织形态学评估。A)H&E染色;B) Masson染色,显示第4周和第8周的骨缺损情况。橙色箭头指示p2支架;黑色箭头指示新骨;红色箭头指示新生血管。
研究团队成功制备了一系列3D打印支架,该支架同时模拟了骨组织的多孔结构和力学性能。具体而言,复合支架的力学性能与松质骨的要求良好匹配,并在低强度脉冲超声作用下提供压电刺激,从而在伴随大量线粒体生物合成的同时增强成骨作用。