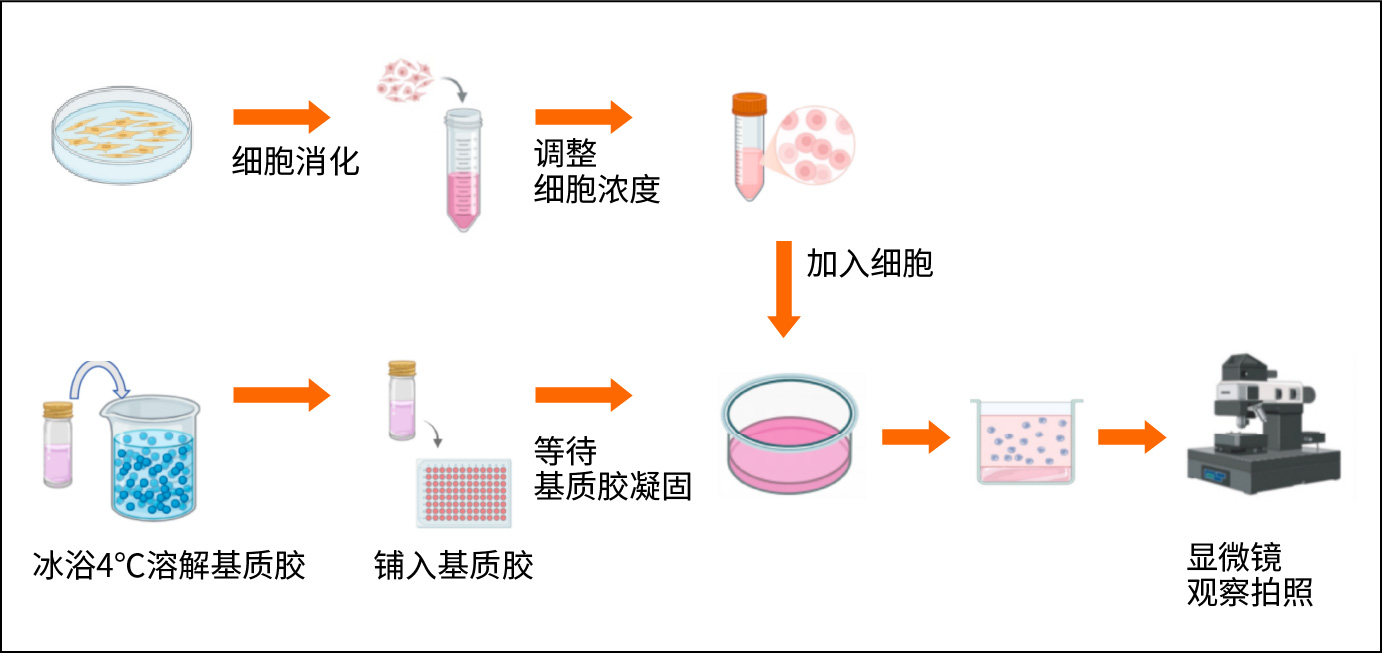
1. 基质胶准备
材料:Matrigel(浓度≥10 mg/mL,如 BD Biosciences 或CORNING 产品)、预冷枪头、冰盒。
操作:
i.解冻:提前 1 天将 Matrigel 置于 4℃冰箱缓慢解冻,解冻时可将基质胶放入冰块中,以确保基质胶能够完全溶解。
ii.铺胶:孔板放置在冰上或低温金属盒上,用预冷枪头将 Matrigel加入至 96 孔板,每孔50-80 μL(24孔板需150-300 μL),吸取基质胶时,为了避免气泡生成,吸胶可至移液枪第二停点,打胶打至第一停点即可。
iii.凝胶化:将板置于37℃培养箱30-60分钟,直至 Matrigel 完全凝固(表面平整无气泡)。
2. 细胞准备
细胞类型:常用细胞包括人脐静脉内皮细胞(HUVEC)、小鼠3B-11细胞系、小鼠SVEC4-10细胞系等。
操作:
i.饥饿处理:实验前将细胞培养基更换为含0.2% FBS的培养基,过夜培养即可,以此增强细胞对生长因子的敏感性。
ii.消化与计数:ii.胰酶消化3-6代细胞,用台盼蓝染色检测活率(>95%),调整密度至 3-5×104 cells/mL。
3. 细胞接种与培养
操作:
i.接种:将细胞悬液加入已凝固的 Matrigel 表面,每孔100-200 μL(HUVEC 推荐密度3-5×104 cells /孔,肿瘤细胞需预实验优化)。
ii.培养:将板置于37℃、5% CO2 培养箱,培养3-12小时(HUVEC 通常6-8小时成管,肿瘤细胞可能需12-24小时)。
4. 观察与染色
方法:
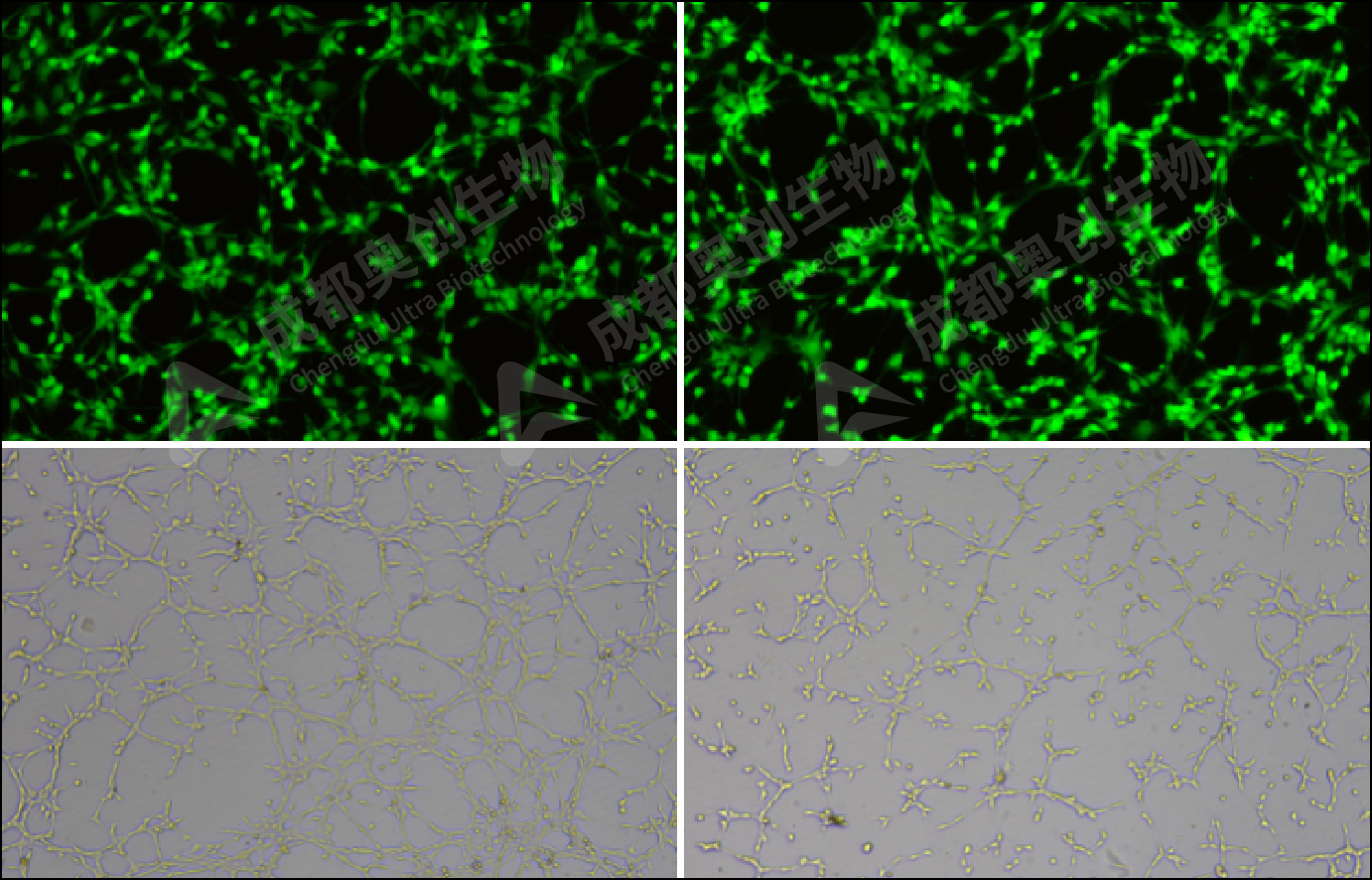
直接观察:相差显微镜下观察管状结构(典型形态为多边形网格,管腔直径约 50-100 μm)。
荧光染色(可选做):
a.移除培养基,无需使用PBS洗涤,反复加入液体洗涤可能会导致管腔结构破坏。
b.加入 Calcein AM(1:1000 稀释),37℃避光孵育 30 分钟。
c.荧光显微镜下拍照(激发波长 494 nm,发射波长 517 nm)。
5. 定量分析
工具:Image J 插件 Angiogenesis Analyzer 或 AngioTool 软件。
指标:
Tot. lenght(管腔长度):反映血管网络复杂度。
Nb branches(支点数):评估血管生成活性。
1. 基质胶处理
温度控制:Matrigel 在 4℃以上易凝固,操作全程需在冰上进行,枪头和 EP 管需预冷。
气泡避免:垂直滴加 Matrigel,避免枪头接触孔壁;若有气泡,4℃、300g 离心 10 分钟。
批次验证:不同批次 Matrigel 成分差异可能影响实验结果,需预实验验证。
样品分装:首次溶解后的Matrigel需直接分装保存于-20℃
2. 细胞状态优化
代数限制:常用细胞包括人脐静脉内皮细胞(HUVEC)、小鼠3B-11细胞系、小鼠SVEC4-10细胞系等。HUVEC建议使用2-6代,原代细胞不超过12代;
密度优化:细胞密度过高易导致管腔重叠,过低则无法形成连续网络,需通过预实验确定最佳密度(96孔板中HUVEC通常3×104 cells /孔)。
饥饿处理:血清饥饿可增强细胞对生长因子的响应,但过度饥饿会导致细胞凋亡,建议饥饿时间不超过 24 小时。
3. 培养条件
时间窗口:HUVEC 成管高峰在 6-8 小时,肿瘤细胞可能延迟至 12-24 小时,需定期观察避免错过最佳拍照时间。
避免扰动:培养过程中避免移动或摇晃培养板,防止破坏脆弱的管状结构。
4. 染色与成像
染色剂选择:Calcein AM适用于活细胞染色,若需要对管腔进行血管相关免疫荧光指标染色。
成像参数:选择低倍镜(如10×)拍摄整体网络,高倍镜(如20×)观察局部细节,确保曝光时间一致以利定量分析。
5. 常见问题与解决方法
四、进阶技巧与优化策略
1. 肿瘤细胞成管实验
基质胶选择:使用低生长因子 Matrigel(如 BD Matrigel Growth Factor Reduced),排除外源性生长因子干扰。
条件培养基:添加肿瘤细胞条件培养基(含 VEGF、bFGF)可增强成管效果。
2. 药物处理
抗血管生成药物:如贝伐珠单抗(Bevacizumab),可在细胞接种时加入,终浓度 1-10 μg/mL。
促血管生成药物:如VEGF重组蛋白,推荐浓度50-100 ng/mL。
3. 3D 培养优化
共培养模型:将内皮细胞与肿瘤细胞或成纤维细胞共培养,模拟肿瘤微环境。
动态培养:使用微流控芯片或旋转培养瓶,引入流体剪切力,促进管腔成熟。
五、结果示例与分析
典型结果:
阳性对照:HUVEC 在 Matrigel 上形成密集的多边形网络,管腔清晰可见。
药物处理组:抗 VEGF 药物显著抑制管腔形成,表现为管状结构减少、分支点稀疏。
定量分析:
统计方法:每组设置 3-6 个复孔,采用单因素方差分析(ANOVA)比较组间差异。
数据呈现:以管状结构总长度、分支点数等指标进行柱状图或折线图展示。
成管实验是研究血管生成的重要工具,其核心在于严格控制实验条件(如基质胶质量、细胞状态)和优化操作细节(如避免气泡、染色技巧)。通过结合荧光染色、定量分析及 3D 培养技术,可深入解析血管生成的分子机制或评估药物疗效。实验中需注意批次差异和预实验优化,以确保结果的可靠性和重复性。