1.1取材前后处理
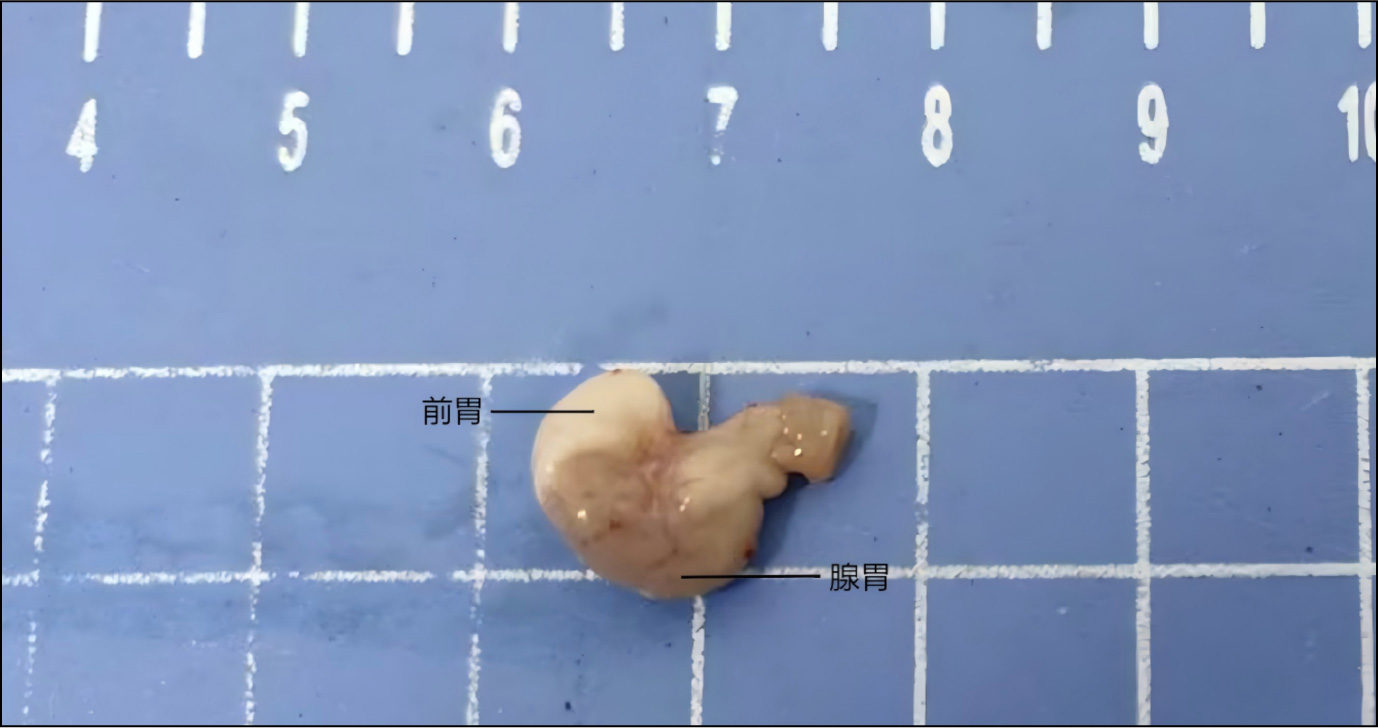
以C57小鼠为例,实验动物适应性喂养7天,处死前禁食24h,自由饮水,处死并取材后用注射器抽取PBS从幽门刺入胃腔,灌注PBS冲洗数次,直到流出的液体基本澄清,以尽可能减少内容物。注意取材时要保留上下各一小段消化道(食管/小肠),方便后续修块。
C57小鼠取材后新鲜组织
1.2固定及后续
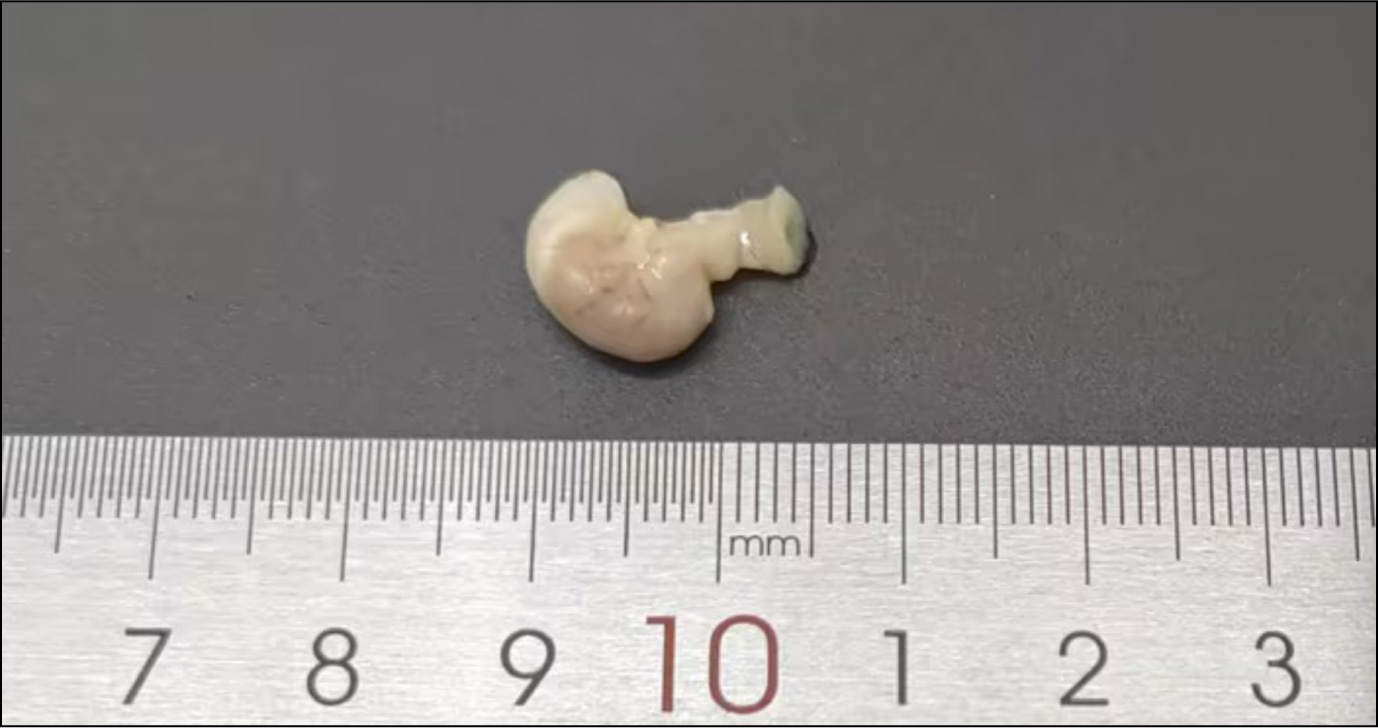
固定液选用4%多聚甲醛(PFA),先用注射器从胃组织一端轻轻注入少量固定液,使胃腔适度充盈(切勿过度膨胀),再完全浸没,固定24h后修整组织块,切面确定为过贲门和幽门最大纵切面,最后将修好的组织块进行脱水、透明、浸蜡、包埋,最终制成石蜡块以备切片。
C57小鼠组织固定后修块

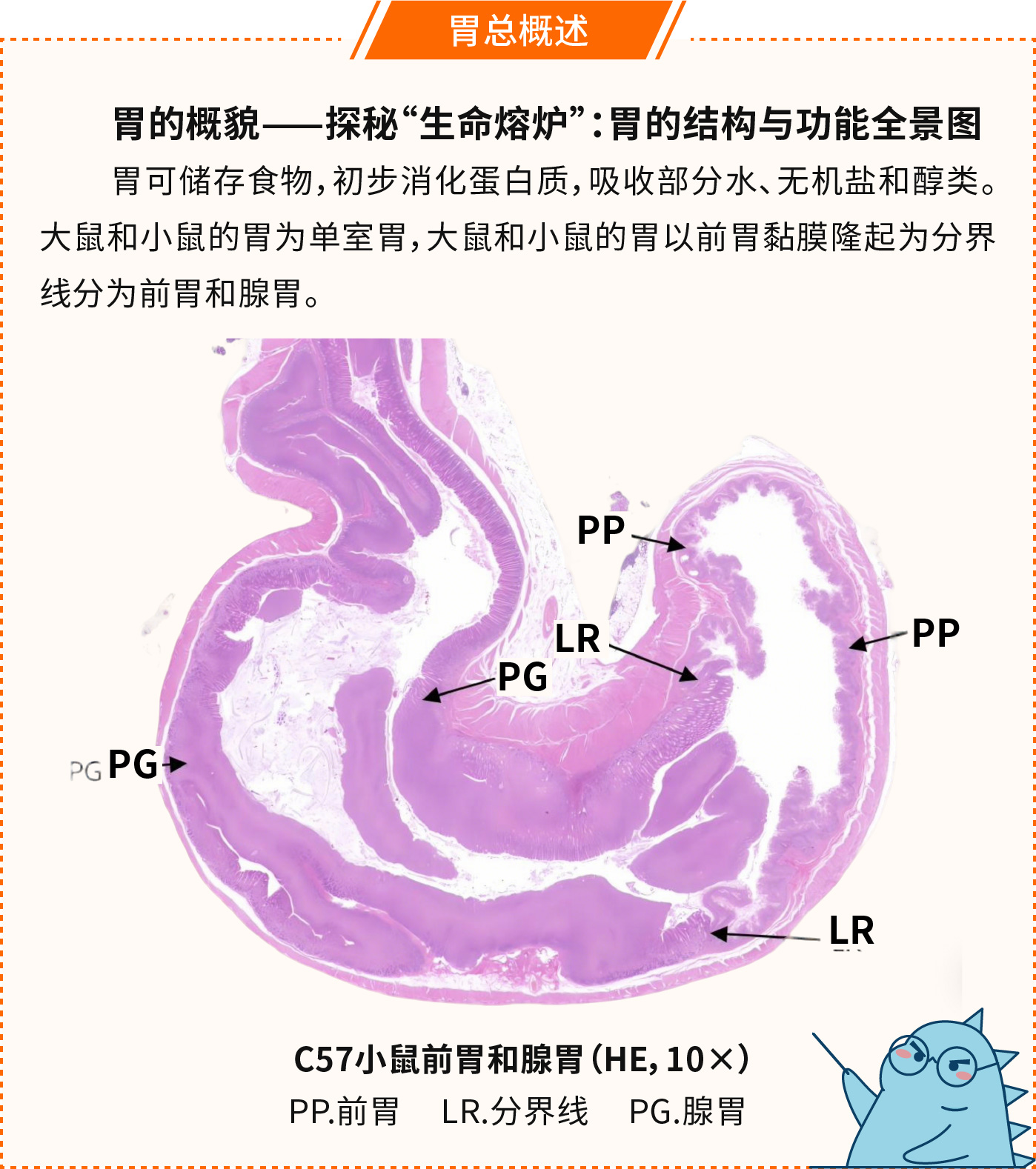
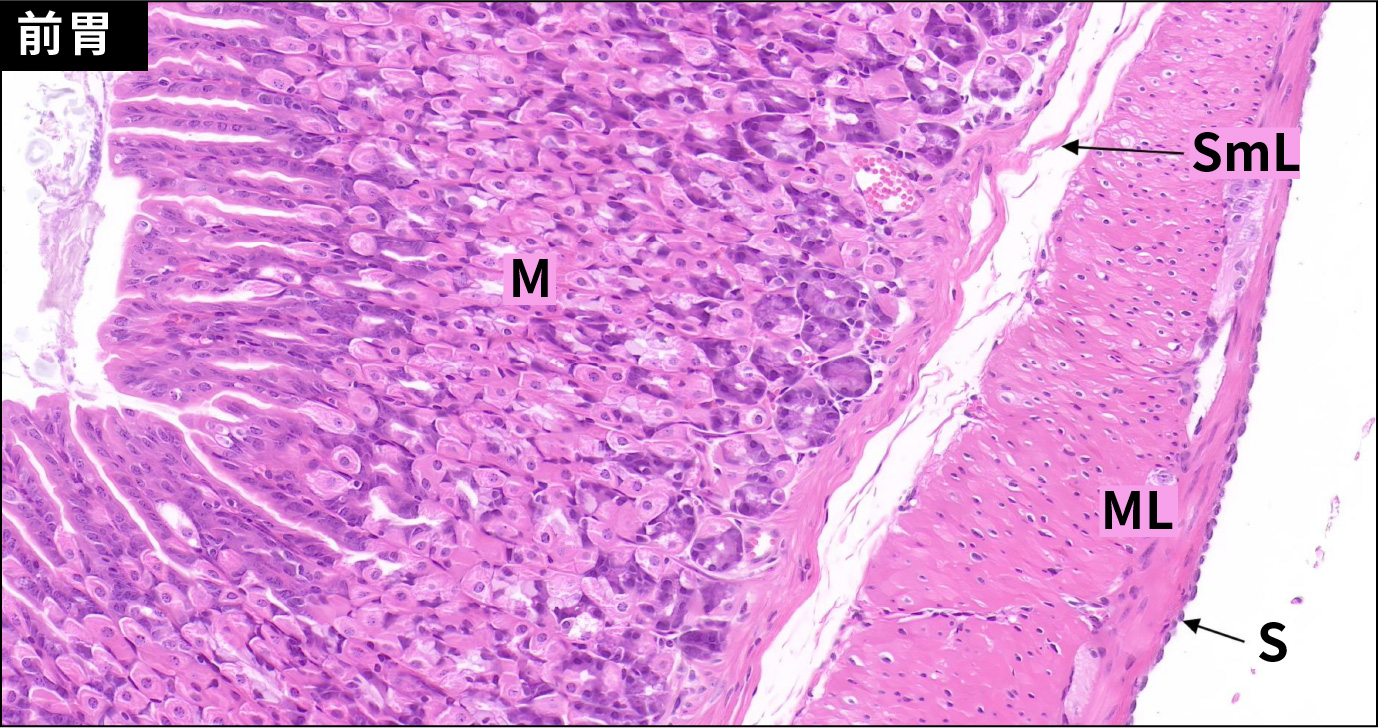
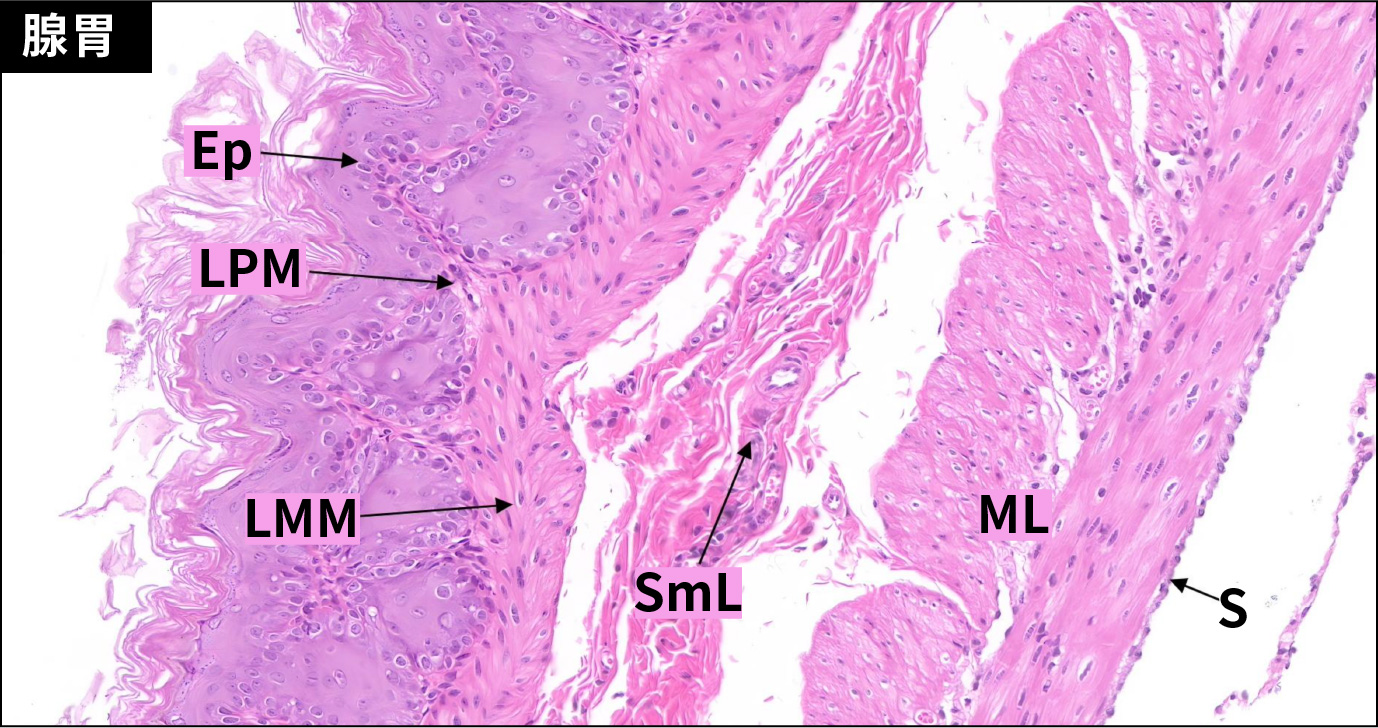
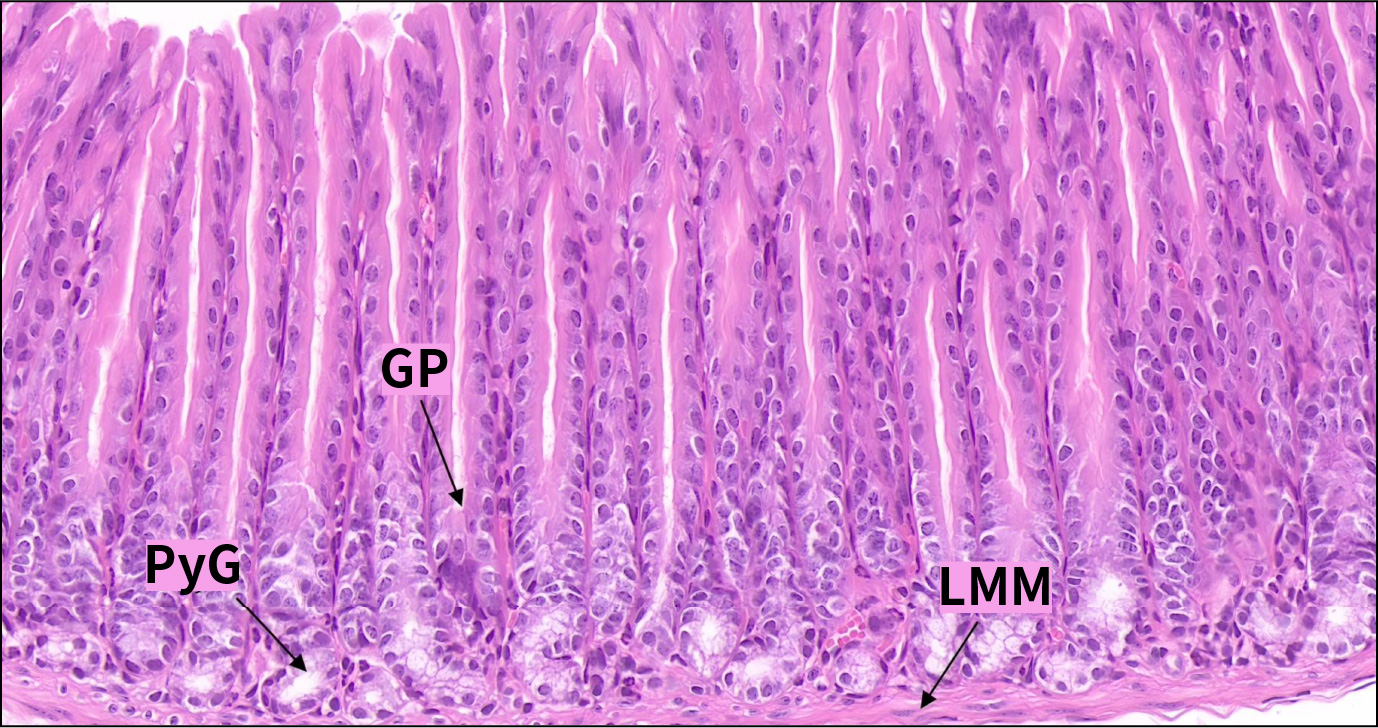
胃由内向外分为黏膜层、黏膜下层、肌层和外膜四层结构。前胃约占2/3,连接食管,黏膜上皮为复层扁平上皮,表面角化,固有层薄,无腺体,黏膜肌层发达。腺胃连接十二指肠,黏膜层被覆单层柱状上皮,固有膜内充满腺体。黏膜下层为疏松结缔组织,富含血管,肌层发达,其间可见神经节细胞,外膜为浆膜。
C57小鼠胃壁的显微结构(HE,200×)
Ep.复层扁平上皮;LPM.固有层;LMM.黏膜肌层;SmL.黏膜下层;ML.肌层;S.浆膜;M.黏膜层
2.1黏膜层
2.1.1上皮
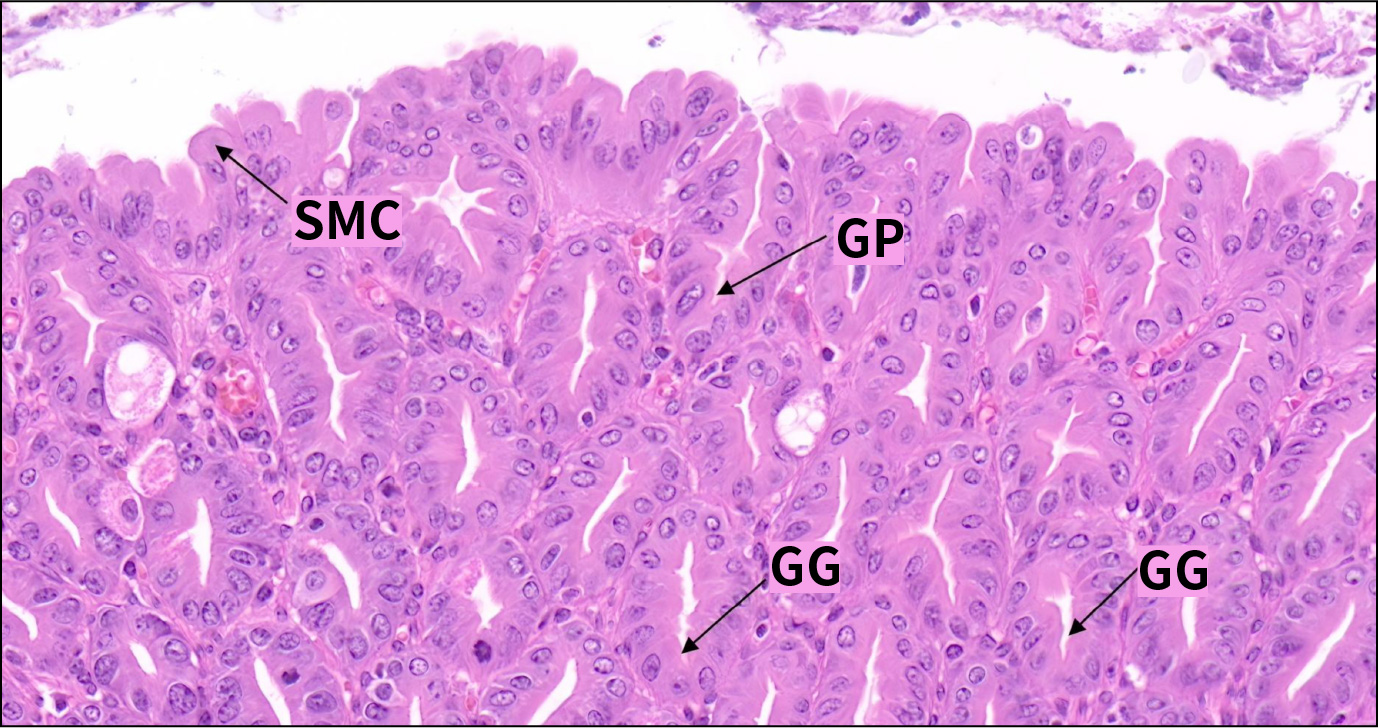
前胃黏膜被覆上皮为复层扁平上皮,表面角化,与食管类似。腺胃黏膜被上皮为单层柱状上皮,主要由表面黏液细胞组成,核椭圆形,位于细胞基部,顶部胞质内充满黏原颗粒。此细胞分泌的黏液覆盖上皮,有重要保护作用。上皮与胃小凹相延续,胃小凹底部与胃腺通连。表面黏液细胞不断脱落,由胃小凹底部的细胞增殖补充。
C57小鼠腺胃黏膜上皮(HE,400×)
SMC.表面粘液细胞;GP.胃小凹;GC.胃腺
2.1.2固有层
前胃固有层内没有腺体。腺胃固有层内有紧密排列的大量胃腺,根据其所在部位与结构的不同,分为胃底腺和幽门腺。胃腺之间及胃小凹之间有少量结缔组织,其纤维成分以网状纤维为主,细胞成分中除成纤维细胞外,还有较多淋巴细胞及一些浆细胞、肥大细胞、嗜酸性粒细胞等。此外,尚有丰富的毛细血管,以及由黏膜肌伸入的、分散的平滑肌纤维。
2.1.2.1胃底腺
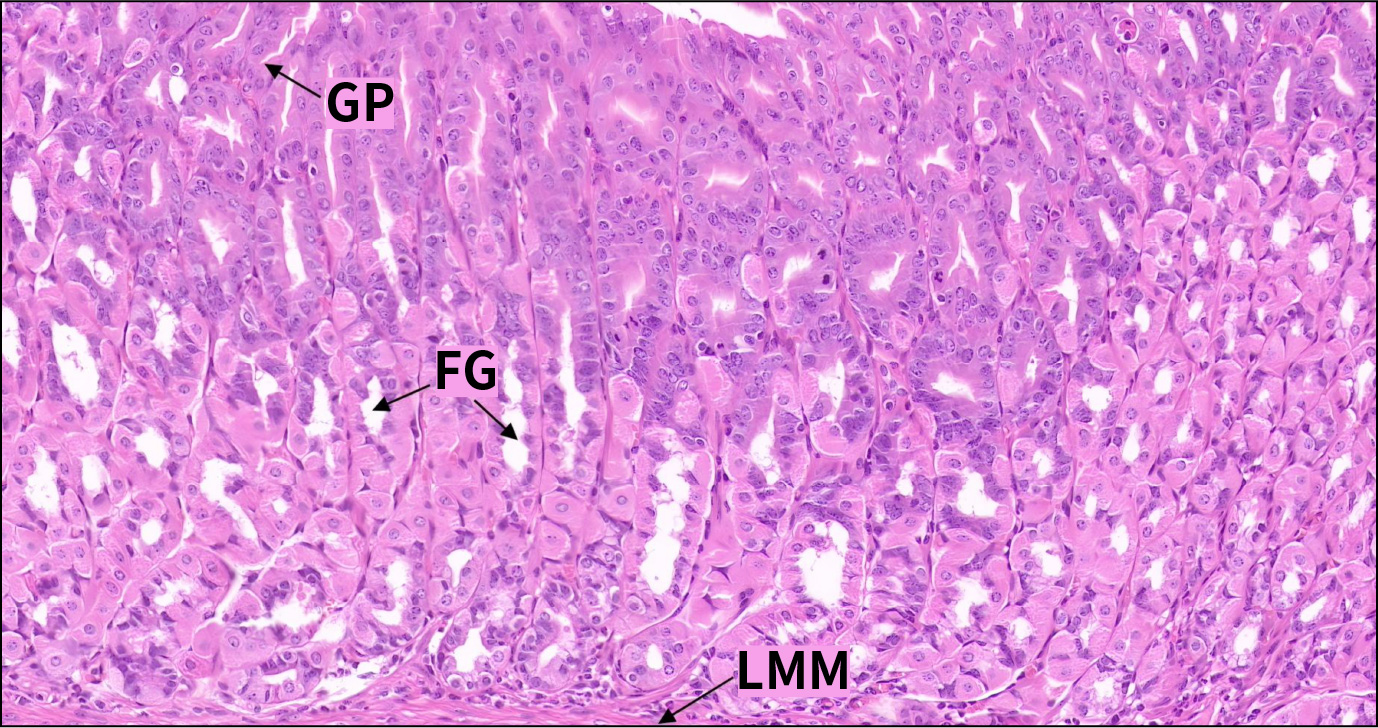
分布于胃底部,是数量最多、功能最重要的胃腺。腺体呈分支管状,上段比较直,开口于胃小凹,下段分支,可分为颈部、体部与底部。胃底腺颈部短而细,细胞增殖活跃,可见核分裂;体部较长;底部略膨大,延伸至黏膜肌层。胃底腺由主细胞、壁细胞、颈黏液细胞及内分泌细胞组成。
C57小鼠胃底腺(HE,200×)
GP.胃小凹;FG.胃底腺;LMM黏膜肌层
2.1.2.2幽门腺
分布于幽门部区域,此区胃小凹较深,胃黏膜表面覆盖中性黏液。幽门腺主要为黏液细胞,分泌中性黏液。
C57小鼠胃幽门部黏膜(HE,300×)
GP.胃小凹;PyG.幽门腺;LMM.黏膜肌层
2.2黏膜下层
黏膜下层为疏松结缔组织,位于发达黏膜肌层下方,内含较粗的血管、淋巴管和神经,尚可见成群的脂肪细胞。
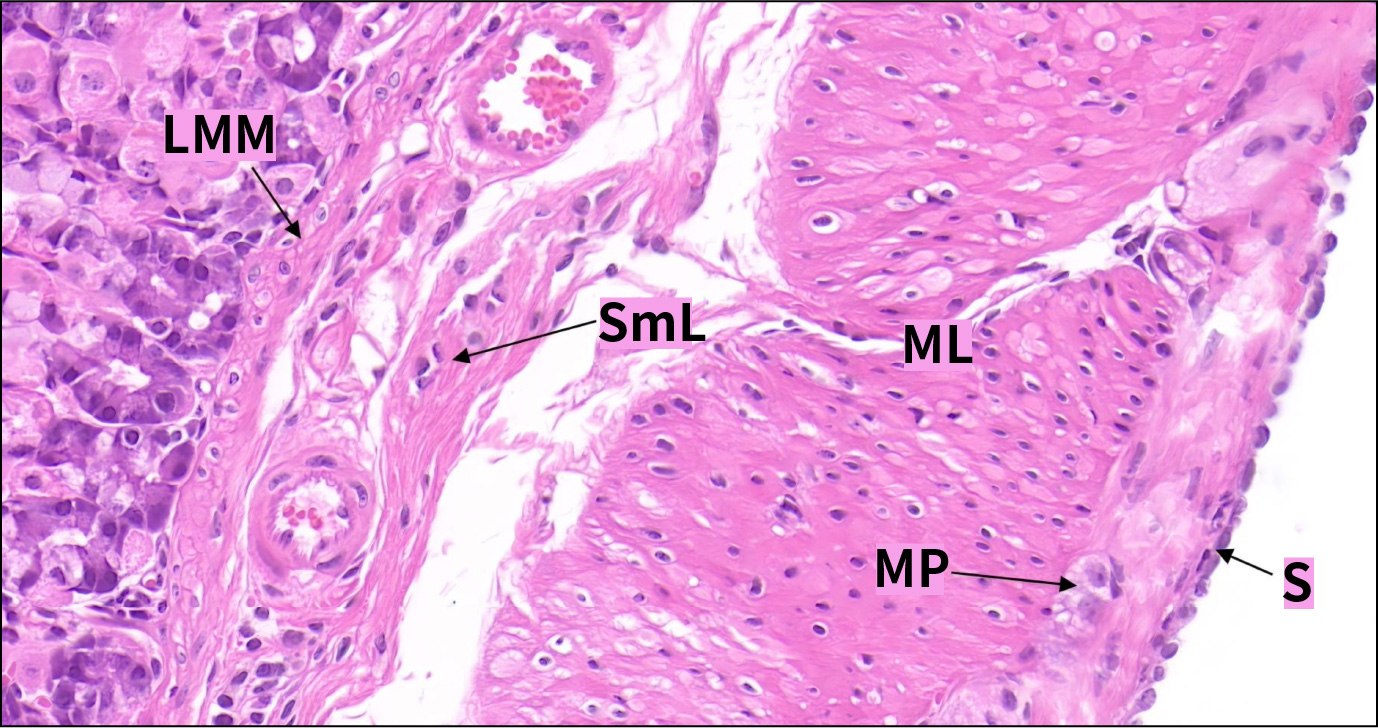
2.3肌层和外膜
肌层发达,一般由内斜行、中环行及外纵行三层平滑肌构成。其间可见肌间神经丛。外膜为浆膜。
C57小鼠胃肌层(HE,400×)
SmL.黏膜下层;LMM.黏膜肌层;ML.肌层;S.浆膜;MP.肌间神经丛

3.1胃溃疡动物模型
3.1.1幽门结扎法致大鼠胃溃疡模型
3.1.1.1造模方法
取SD大鼠雌雄各半,戊巴比妥钠0.03g·kg-1体重麻醉,无菌条件下切开腹壁皮肤、肌层,暴露胃,在幽门与十二指肠的连接处将幽门结扎,缝合腹壁切口,置不锈钢饲养笼中,绝对禁食禁水。
15h后,处死大鼠,打开腹腔,在近横膈处结扎食管,将胃取出,然后用10%福尔马林固定,进行常规病理制片及光镜检查。
3.1.1.2形态学表现
幽门结扎后可刺激胃液分泌,造成胃内高酸度,损伤胃黏膜。这种方法复制的动物溃疡模型与人类典型溃疡及乙酸法复制的动物溃疡不同,病理主要表现为胃壁充血、水肿、炎细胞浸润,黏膜糜烂,严重者可导致从黏膜层起始的胃壁不同程度的坏死,坏死处一般无明显肉芽组织增生。因而本法复制的模型最好称为“急性胃炎,伴糜烂和(或)出血、坏死”。适用于研究胃溃疡发病学及探索抗溃疡药物的研究。
3.1.2乙酸法致大鼠胃溃疡模型
3.1.2.1造模方法
SD大鼠,雌雄各半,所有大鼠实验前禁食24h,自由饮水,用0.6%戊巴比妥钠按0.5ml·100g-1体重麻醉,碘酒消毒后,沿腹中线剑突下方打开腹腔,取出胃,将内径5mm、长约30mm的塑料管垂直放于胃体浆膜面上,位置近幽门端,向管内加入乙酸0.2 ml,1 min后用棉球吸尽乙酸,将胃放回原处,缝合切口。术后连续三天注射青霉素。术后第10天禁食24h,第11天开腹,结扎幽门后关闭腹腔,4h后结扎贲门,剪取胃体,处死大鼠,将胃置于10%福尔马林液中固定,常规病理切片。
3.1.1.2形态学表现
这种方法复制的动物溃疡模型,在肉眼观察及光学显微镜下与人类溃疡相似。肉眼观胃黏膜坏死,形成明显的缺损。光镜下溃疡有四层组成,由腔面到浆膜面依次为炎细胞及纤维素组成的炎性渗出层,坏死组织层,新鲜肉芽组织层,新鲜肉芽组织及瘢痕组织移行层。一般在术后3天-5天即形成胃溃疡,在60天左右可自行愈合。
3.2胃原位瘤动物模型
3.2.1原位移植法
3.2.1.1造模方法
取SD大鼠雌雄各半,培养并收集对数生长期的胃癌细胞(如鼠源MFC细胞),用PBS或基质胶重悬。小鼠麻醉后,仰卧位固定,腹部消毒,于上腹正中切口约1cm,轻轻拉出胃(通常选择胃大弯前壁或后壁),用微量注射器(配30G针头)吸取10-50μL细胞悬液(约1×10^6个细胞),针头以浅角度刺入浆膜下,缓慢推注,形成一个清晰可见的白色水泡。拔针后,用无菌棉签轻压片刻防止渗漏,将1-2 mm³的肿瘤组织块塞入预先在胃壁上切好的小口内,缝合固定。将胃小心放回腹腔,逐层缝合肌肉和皮肤。约2-4周后可触及或通过活体成像(若细胞带荧光/荧光素酶标记)监测肿瘤生长。
3.1.1.2形态学表现
这种方法建立的胃肿瘤动物模型,其形态学表现在肉眼观及光学显微镜下具备典型特征。肉眼观,于胃壁移植部位可见明确的实性肿瘤结节,质地较硬,边界相对清晰,呈灰白色或粉红色,常伴有表面血管增生。肿瘤可向胃腔外突起,亦可向胃壁深层浸润,导致局部胃壁增厚、僵硬,晚期可形成中心坏死性溃疡。
光镜下,肿瘤组织呈浸润性生长,破坏正常胃壁层次结构,其形态取决于所移植的细胞系类型。通常由不规则的恶性上皮细胞巢或腺管构成,细胞异型性明显,核大深染,核分裂象易见。肿瘤边缘常可见癌组织向黏膜下层、肌层乃至浆膜层侵袭,并可能伴有血管或淋巴管内癌栓。肿瘤间质中可见数量不等的纤维组织增生及炎性细胞浸润。一般在术后2-4周即可形成肉眼可见的肿瘤,其生长速度和转移潜能可通过活体成像或定期解剖进行动态监测,且通常无法自行消退。