细胞死亡调控在癌症治疗领域具有独特的价值。近年来,双硫死亡(disulfidptosis)引起了大量的科学关注。之前的研究表明,声动力学治疗(sonodynamic therapy, SDT)可以通过激活细胞活性氧(ROS)调节癌细胞死亡,以达到有限的抗癌作用。然而,将声动力学治疗与双硫死亡相关联作为抗癌策略尚未得到广泛的发展。在本研究中,研究者构建了一种人工膜双硫死亡超声增敏剂,它是一种结合了化疗药物索拉非尼(Sora)和氯蛋白Ce6的纳米脂质体(SC@lip)。这种纳米脂质体可以增强SDT效应,诱导双硫死亡样癌细胞死亡。
成都奥创生物参与了名为《Bioactive Nanoliposomes for Enhanced Sonodynamic-Triggered Disulfidptosis-Like Cancer Cell Death via Lipid Peroxidation》的实验项目,这项研究为抗癌领域提供了一种有前景的策略,具有巨大的潜在临床应用价值。
Smart zwitterionic coatings with precise pH-responsive antibacterial functions for bone implants to combat bacterial infections
文章名:
Bioactive Nanoliposomes for Enhanced Sonodynamic-Triggered Disulfidptosis-Like Cancer Cell Death via Lipid Peroxidation(生物活性纳米脂质体通过脂质过氧化增强声动力促进癌细胞的双硫死亡。)
International journal of nanomedicine, 19, 8929–8947
DOI: 10.2147/IJN.S464178
挂名引用:
期刊介绍:
期刊名:International journal of nanomedicine
2024年影响因子/JCR分区:6.7/Q2
学科与分区:PHARMACOLOGY & PHARMACY(Q2);NANOSCIENCE & NANOTECHNOLOGY(Q3)
出版国家或地区:NEW ZEALAND

细胞死亡相关通路一直是癌症治疗领域所关注的重要内容。细胞的双硫死亡(Disulfidptosis)是一种全新的细胞死亡类型。与其它细胞死亡机制不同,双硫死亡与肌动蛋白细胞骨架 (actin cytoskeleton) 有关。肌动蛋白细胞骨架是一种对维持细胞形状和存活至关重要的细胞结构,由肌动蛋白丝组成,肌动蛋白丝赋予细胞整体形状和结构。细胞的双硫死亡是由于细胞内胱氨酸(cystine)和二硫化物的累积导致。在细胞内,NADPH可以和二硫化物相互作用以维持平衡,但是当在某种特殊条件下,如:葡萄糖饥饿条件下,SLC7A11高表达细胞内NADPH被大量消耗,胱氨酸等二硫化物异常积累,就会诱发二硫化物应激 (disulfide stress)和细胞的双硫死亡。在这个过程中,LPO (乳过氧化物酶)的堆积是NADPH的过度消耗的标志。
溶质载体家族成员 SLC7A11(Solute Carrier Family 7 Member 11,又名 xCT)是溶质转运第 7 家族的第 11 个成员,属于胱氨酸/谷氨酸逆向转运蛋白,主要参与氨基酸在质膜上的转运。这也是癌细胞赖以存活的重要通路。生物正交化学蛋白组学实验表明,在 SLC7A11高表达癌细胞中,葡萄糖匮乏时二硫键增加最显著的蛋白主要集中在肌动蛋白细胞骨架和细胞粘附相关的生物过程或途径。
声动力疗法(SDT)利用超声波对生物组织有较强的穿透能力,尤其是聚焦超声能无创伤地将声能聚焦于深部组织,并激活一些声敏药物(如血卟啉)产生抗肿瘤效应。纳米声敏剂在治疗过程中可以增强细胞内ROS水平,从而引发脂质过氧化,最终导致细胞死亡。而且,SDT与脂质过氧化损伤的整合可以绕过细胞凋亡途径,从而克服一些肿瘤对细胞凋亡的固有抵抗。
研究团队开发了一种SDT声敏剂(命名为SC@Lip),它是一种Sorafenib-Ce6的纳米脂质体。SC@Lip可以增强细胞内ROS水平的同时,增强SLC7A11蛋白的表达,从而导致细胞双硫死亡。
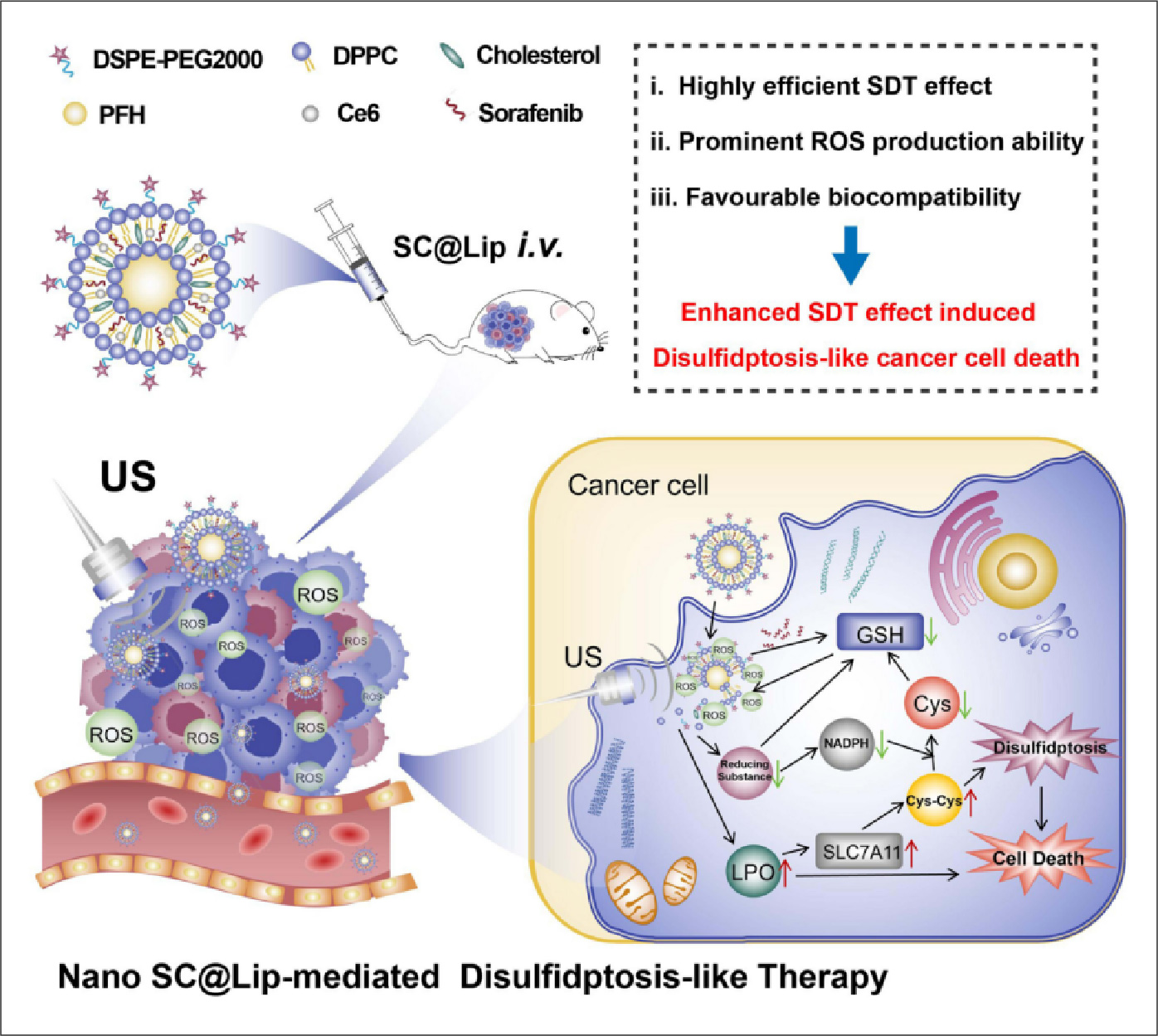
图1SC@Lip成分及其导致肿瘤细胞双硫死亡的示意图:
要点一:
运用旋转蒸发超声乳化法(rotary evaporation phacoemulsification)合成SC@Lip。SC@Lip是一种球状结构,其悬浮液呈深绿色,并且SC@Lip结合了化疗药物索拉非尼(Sora)和氯蛋白Ce6。研究者团队通过测试证明了SC@Lip能提升细胞内ROS活性,从而提升声动力疗法的疗效。
要点二:
SC@Lip具有良好的生物活性,并且使用纳米脂质体(250μg/mL)联合US(0.5W/cm²,30s)是驱动有效的SDT效应和癌症治疗的合理选择。
要点三:
实验证明SC@Lip可以吞噬肿瘤细胞4T1,同时具有很强的细胞毒性,说明SC@Lip可以促进肿瘤细胞死亡。在SDT治疗中,SC@Lip可以提升细胞内ROS和GSH水平从而增强SDT治疗效果。在SC@Lip介导的SDT治疗过程中,细胞内脂质过氧化增强,细胞骨架发生崩塌。
要点四:
在小鼠体内,SC@Lip介导的SDT疗法能有效抑制肿瘤生长,并且在SLC7A11蛋白高表达的癌细胞收到的抑制作用最强。同时SC@Lip具有较高的生物安全性,并在注射后24小时达到峰值。
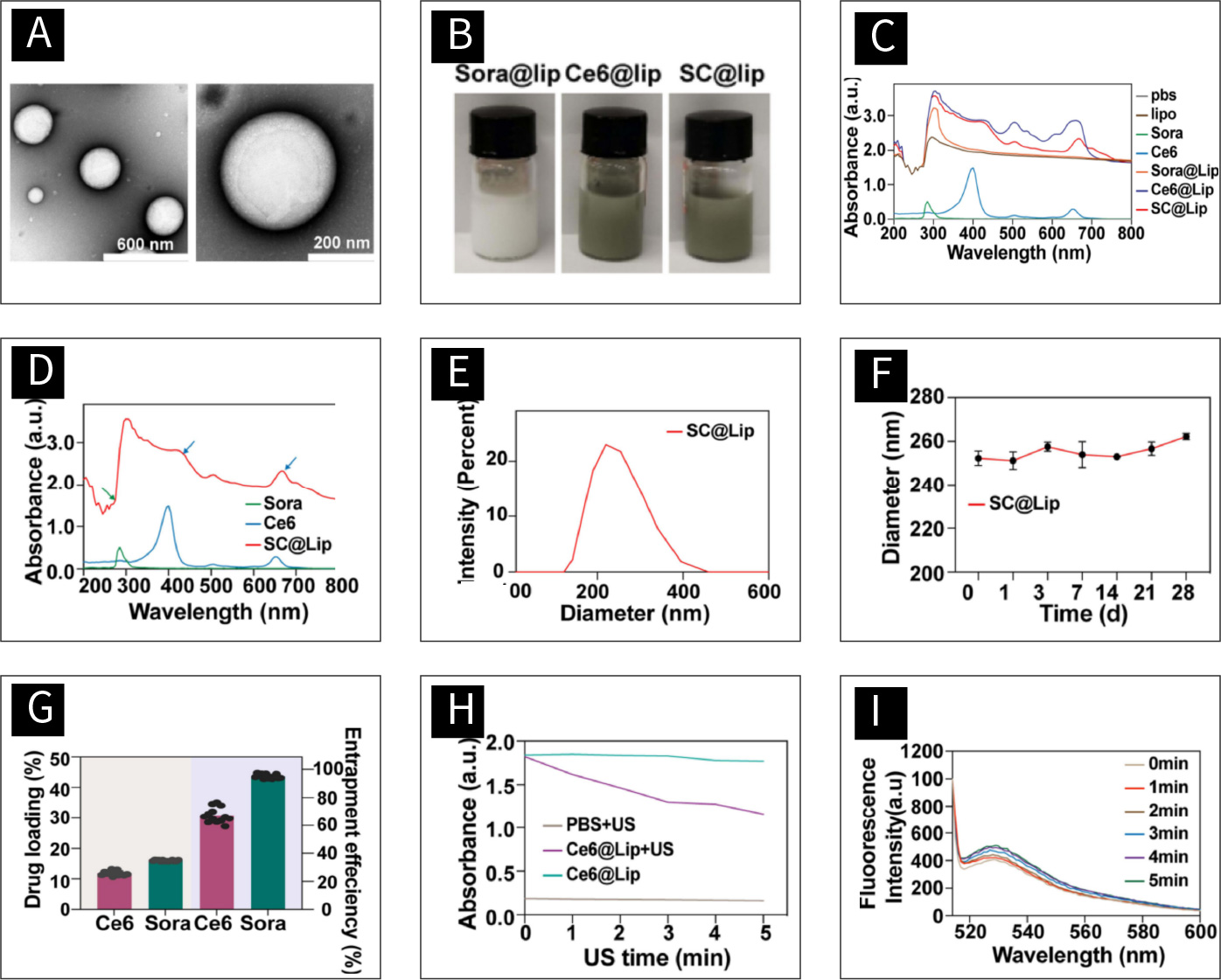
图2 SC@Lip的特征:
(A)透射电子显微镜下SC@Lip的形态。(B) Sora@Lip, Ce6@Lip 和 SC@Lip的照片。(C)脂质、Sorafenib、Ce6、Sora@Lip、Ce6@Lip 和 SC@Lip的UV-Vis-NIR吸收光谱。(D)Sorafenib, Ce6和SC@Lip的UV-Vis-NIR吸收光谱。(E)SC@Lip的流体动力学直径。(F)28天内SC@Lip的流体动力学直径。(G)Sorafenib和 Ce6在SC@Lip的载药率和包封率。(H)DPBF的吸收峰。(I)超声波照射下SC@Lip的SOSG荧光光谱。
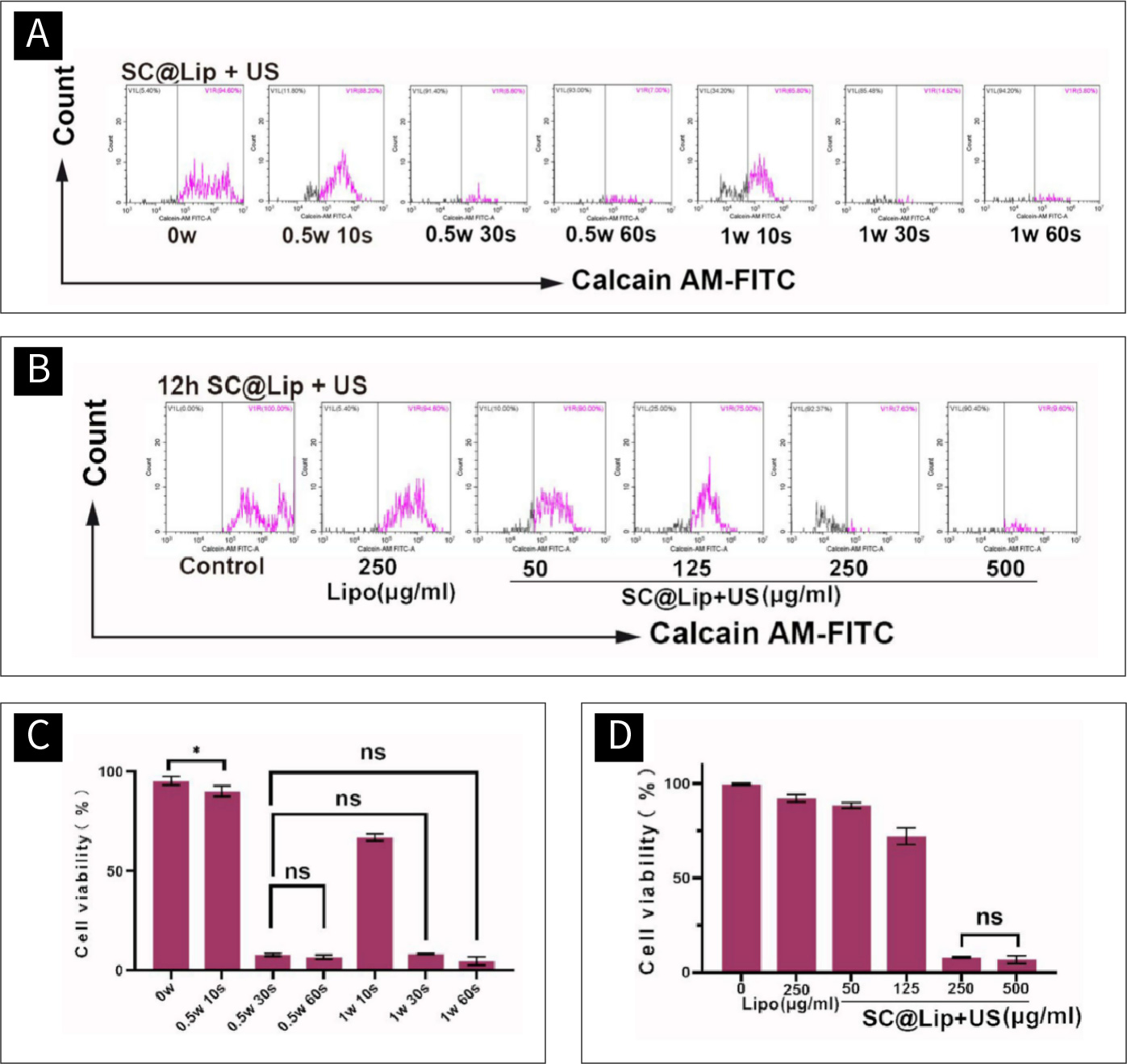
图3 SC@Lip的运用与最佳超声波参数的选择:
(A)超声参数选择的 Calcain-AM FCM图。(B)SC@Lip最佳选择的Calcain-AMFCM图。(C)超声波参数选择的统计直方图。(D)SC@Lip选择的应用比例的统计直方图。(ns means no statistical difference, *p< 0.05)。
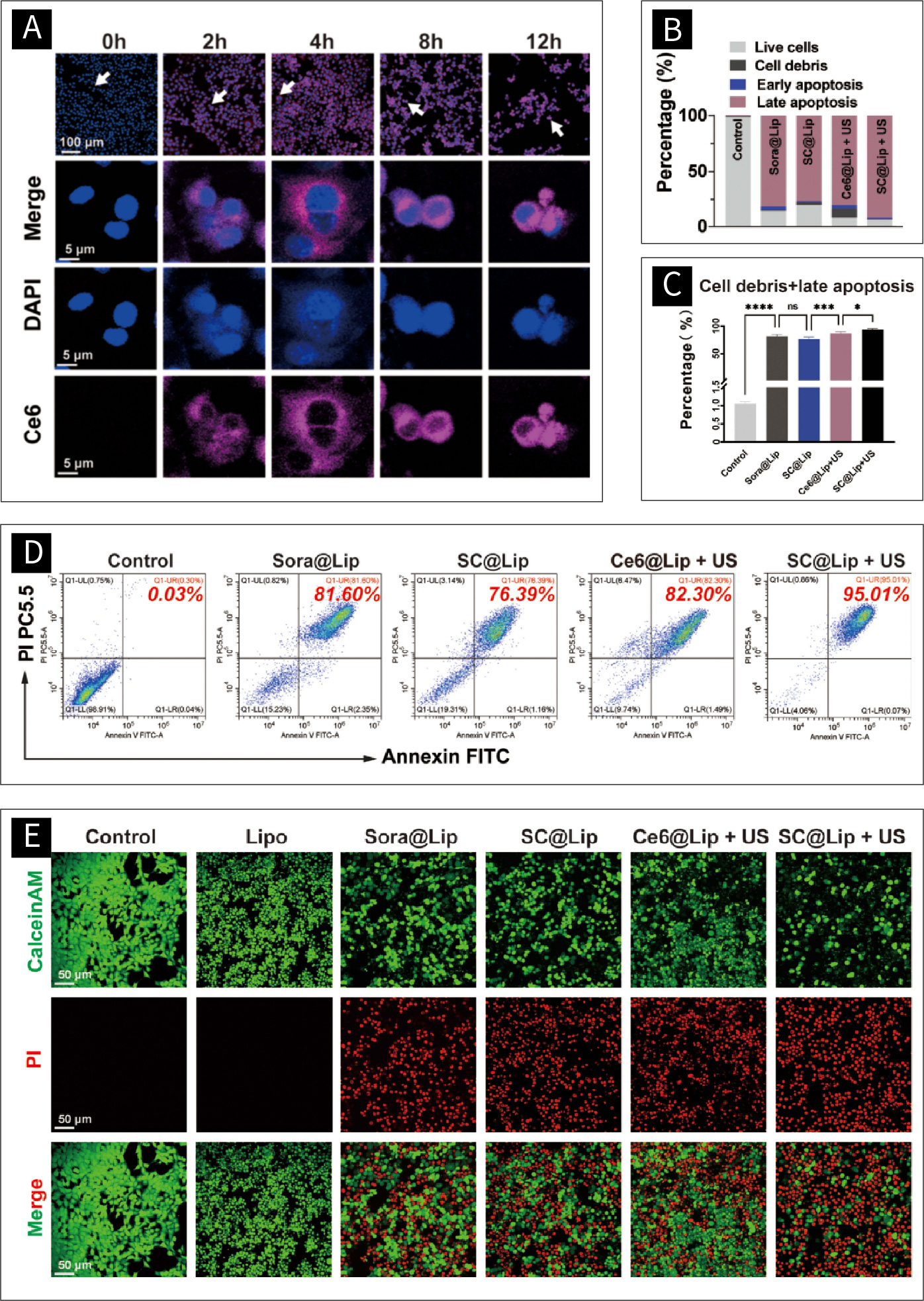
图四 SC@Lip的细胞内吞噬作用及其SDT治疗效果:
(A)激光共聚焦显微镜下SC@Lip对癌细胞4T1的吞噬作用。(scale bar:100 μm, 5μm) (B-D)流式细胞术测定Annexin-V/PI双染细胞凋亡。(*p < 0.05, ***p < 0.001, ****p < 0.0001)
图五 细胞内ROS和GSH水平的测定:
(A)激光共聚焦显微镜下被处理后的癌细胞4T1。(scale bar:50μm) (B-C)流式细胞术测定DCFH-DA。(D)各组处理4T1细胞后检测GSH含量(n=3)。纳米脂质体浓度为250μg/mL,细胞孵育12h。SDT组的超声参数为0.5 W/cm2,30s。(****p < 0.0001)
图6解析:
在STD疗法中,SC@Lip促进了细胞脂质过氧化物的形成,从而导致细胞双硫死亡。(A-B)激光共聚焦显微镜下被处理后的癌细胞4T1。(scale bar:50μm,5μm) (B)使用的抗体为Anti-SLC7A11(Alexa Fluor 555)和F-actin(Alexa Fluor 488)。
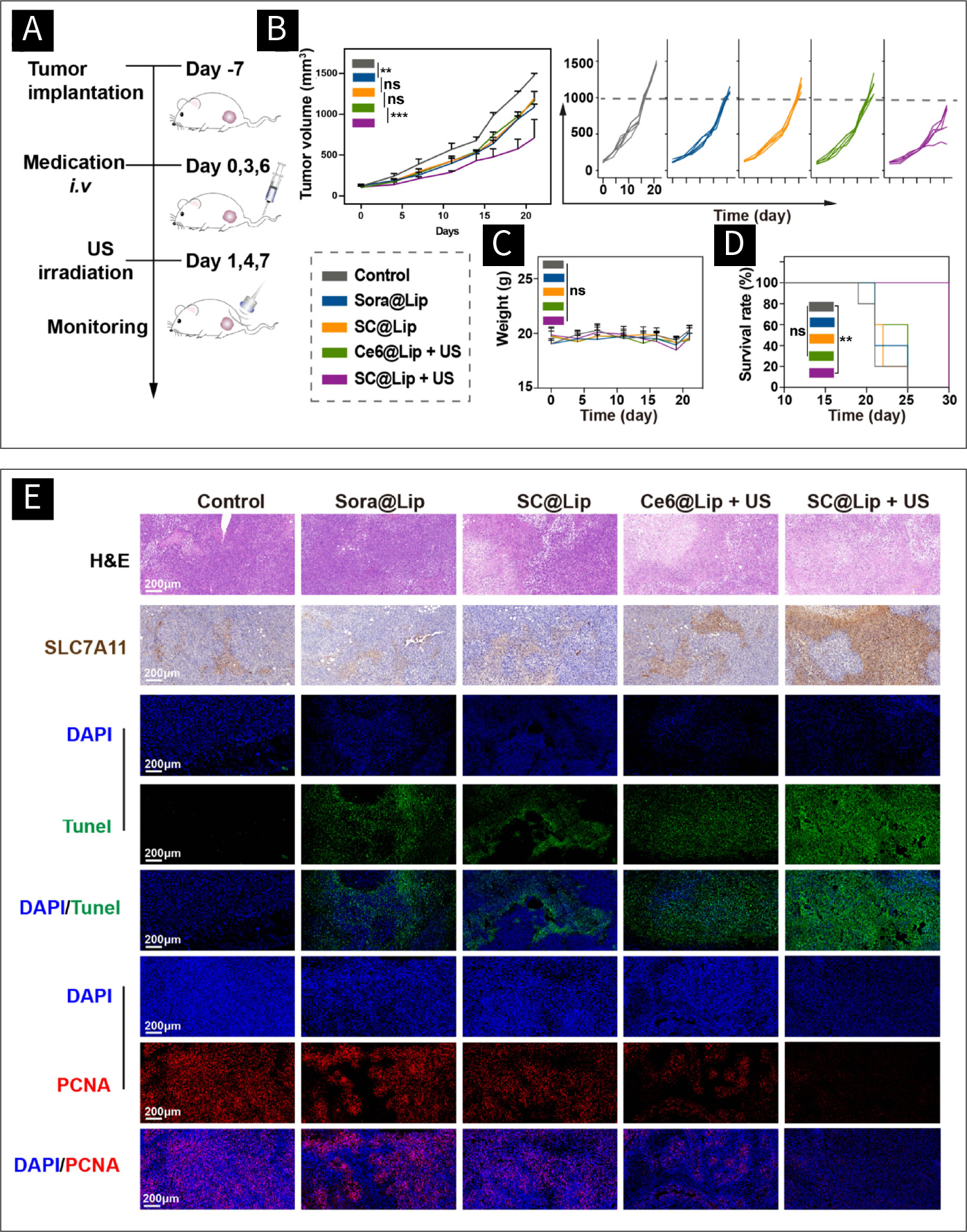
图七 SC@Lip介导的SDT疗法在小鼠体内的治疗效果:
(A)实验流程示意图。(B治疗组皮下肿瘤体积生长曲线及各治疗组单只小鼠肿瘤体积生长曲线。 (C)治疗期间各组小鼠的体重曲线。(D)治疗期间各组小鼠的生存曲线。(E)不同组肿瘤组织的H&E染色、SLC7A11 IHC、TUNEL染色和PCNA染色。(scale bar: 200μm) (ns means no statistical difference, **p < 0.01, ***p < 0.001)
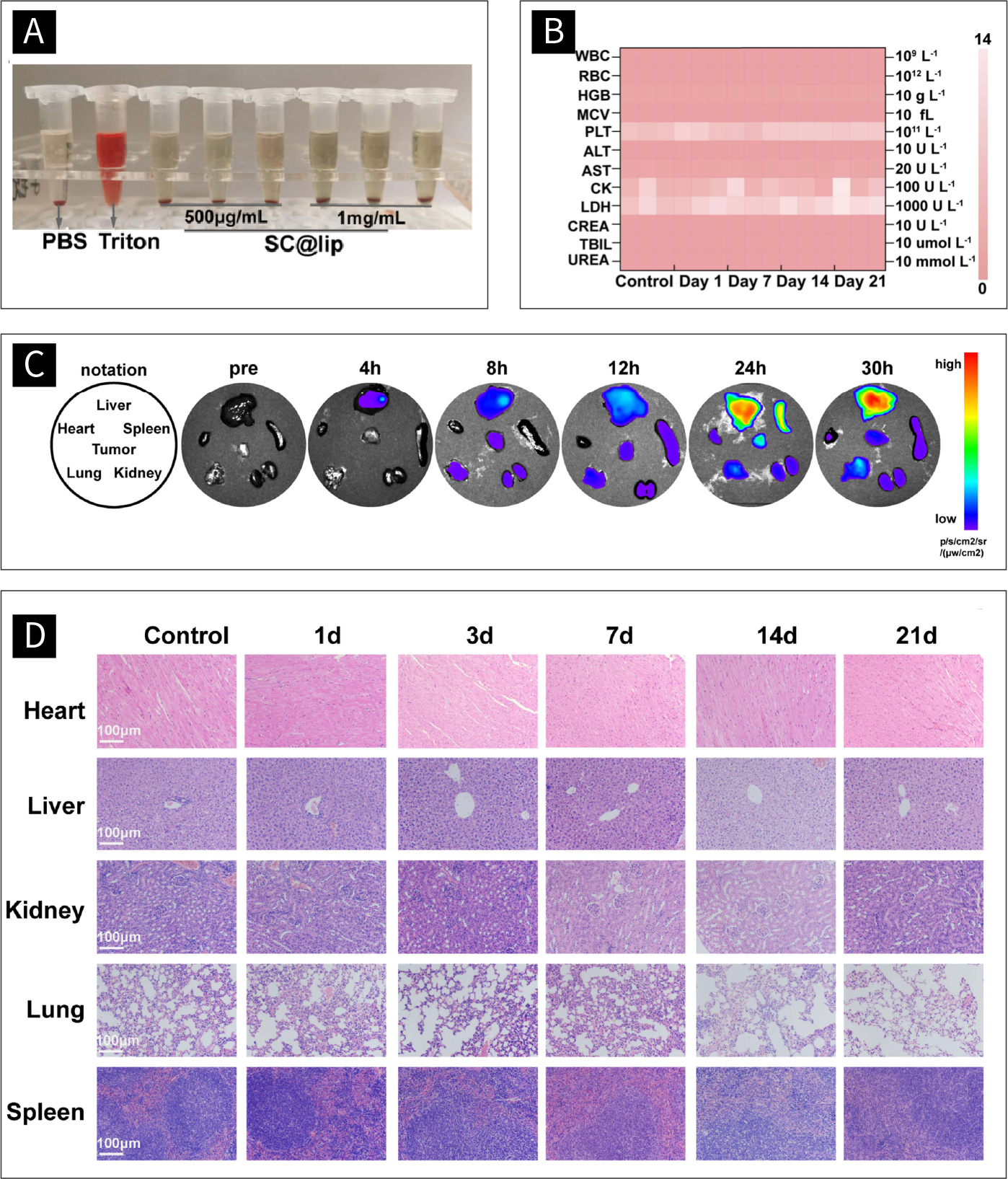
图八 SC@Lip的生物安全性:
(A)SC@Lip的溶血实验。(B)用SC@Lip处理的健康小鼠的血液生化试验。 (C)不同时间点的组织荧光图像。(D)用SC@Lip处理的健康小鼠的主要器官H&E染色(scale bar: 100μm)
作者研发出一种纳米脂质体材料可以用于SDT治疗,可以有效抑制肿瘤细胞的生长,促进肿瘤细胞胞内ROS水平和脂质过氧化物的形成,从而促进肿瘤细胞的双硫死亡。SC@Lip在超声(US)照射下产生足够的ROS,诱导细胞内大量脂质过氧化物(LPO)强化,导致癌细胞中SLC7A11蛋白的表达大幅增加,促进二硫酸化应激的积累。同时,细胞内的还原物质,如谷胱甘肽(GSH)和NADPH被过度消耗。这导致细胞无法运输胱氨酸,导致二硫醚的积累,最终导致二硫酸中毒。这两种机制协同增强SDT的抗癌作用,触发细胞的双硫死亡,并在体内外实现抗肿瘤疗效。因此,SC@Lip有望成为一种有效的诱导肿瘤细胞双硫死亡的SDT超声增敏剂,为纳米脂质体作为抗癌声增敏剂的研究提供了一个有前途的策略。