糖尿病视网膜病变(DR)是典型的糖尿病微血管并发症,玻璃体内给药是主要的治疗方法。此前的研究表明,线粒体靶向药物为DR提供了有希望的治疗选择。在本研究中,研究者构建了线粒体靶向成像和治疗性纳米系统PP-TRh-RSV,该系统可以通过调节RAGE/Nf-κB/iNOS和RAGE/NNOS/Nf-κB/VEGF通路,从而抑制DR中视网膜新生血管的形成和降解;这种靶向成像和治疗纳米系统PP-TRh-RSV也可提供持续的药物释放、增强的光化学稳定性和生物利用度。因此,PP-TRh-RSV是DR靶向治疗和监测的有前途的候选药物。
成都奥创生物参与了名为《A trackable mitochondria-targeting nanosystem for mitochondrial redox and mitophagy regulation in diabetic retinopathy management》的实验项目,这项研究为糖尿病视网膜病变(DR)治疗提供了一种很有前景的线粒体靶向治疗和监测的候选药物,具有巨大的潜在临床应用价值。
Smart zwitterionic coatings with precise pH-responsive antibacterial functions for bone implants to combat bacterial infections
文章名:
A trackable mitochondria-targeting nanosystem for mitochondrial redox and mitophagy regulation in diabetic retinopathy management(一种用于糖尿病视网膜病变管理中的线粒体氧化还原和线粒体自噬调节的可追踪的线粒体靶向纳米系统。)
Chemical Engineering Journal, 505 (2025) 159618
DOI:10.1016/j.cej.2025.159618
挂名引用:

期刊介绍:
期刊名:Chemical Engineering Journal
2024年影响因子/JCR分区:13.3/Q1
学科与分区:ENGINEERING, CHEMICAL - SCIE(Q1);ENGINEERING, ENVIRONMENTAL - SCIE(Q1)
出版国家或地区:SWITZERLAND

糖尿病视网膜病变(DR)是一种广泛存在的微血管并发症;是一种与氧化应激相关的眼部疾病,通常以活性氧(ROS)的过量产生为特征。常用的治疗方法包括激光光凝、抗血管内皮生长因子(anti-VEGF)药物和类固醇药物。然而,这些治疗手段都存在些许副作用。
线粒体是参与ROS生成的主要细胞器。研究表明,线粒体靶向治疗调节氧化应激可有效减轻体外DR。然而,过量的ROS作为氧化应激的特征,会破坏自噬的稳态。当受损的线粒体不能被有效清除时,它们不仅损害细胞的能量供应,还会继续产生ROS,进一步加剧氧化应激。维持一个健康的线粒体群对于氧化还原平衡至关重要。
白藜芦醇(Resveratrol,RSV)是葡萄中存在的一种天然多酚植物抗毒素,可调节线粒体保护的多种途径。RSV的直接线粒体靶向能够有效清除线粒体内ROS,然而,RSV有限的细胞摄取效率和缺乏细胞器选择性导致其生物利用度较差,限制了其在临床中的有效性和应用。因此,需要一种具有高细胞内效率、靶向递送和理想生物相容性的新型RSV给药系统。
四面体框架核酸(tFNAs)有优异的生物相容性和生物利用度,可以被设计成稳定的多面体结构。由于其特殊的设计灵活性,tFNA可以根据需要定制为最佳的药物载体。此外,tFNAs丰富的载药位点允许插入RSV,从而提高RSV的构象稳定性和细胞进入效率。原始tFNAs携带者经历快速溶酶体清除,限制了有效的线粒体靶向。因此,通过线粒体靶向和线粒体逃逸来优化tFNA对于增强RSV的治疗功效也至关重要。
罗丹明19是一种离域亲脂性阳离子。它的亲脂性使其能够穿透疏水膜,而正电荷使其能够被带负电荷的线粒体内膜所吸引。其高荧光量子产率使其具有标记价值,为成像提供清晰明亮的信号。此外,由于罗丹明19可以通过酰胺键与DNA结合,因此它也可能与tFNAs结合。正是由于这些特性,用罗丹明19修饰tFNAs可能实现线粒体靶向并同时监测。此外,为了确保有效的线粒体靶向,防止药物进入细胞后被溶酶体降解是至关重要的。聚乙二醇化鱼精蛋白(PP)已被证明能显著保护tFNA不受溶酶体降解,从而延长体内清除时间。细胞内化后,阴离子溶酶体膜吸引带正电荷的PP,使其聚集在膜上。这种电荷相互作用导致膜破裂或紊乱,从而促进溶酶体逃逸。
论文研究团队构建了一个可追踪的线粒体靶向纳米系统,该系统可连续释放RSV并维持RSV的光化学稳定性。此外,该纳米系统显示出高效的细胞摄取和准确的线粒体靶向,促进线粒体ROS清除和线粒体自噬调节,从而减轻血管渗漏和血管生成。受益于罗丹明的荧光反应性,通过临床眼科诊断设备监测其在眼底的实时分布。基于代谢评估的每周给药通过下调RAGE/Nf-κB通路在体内减轻微血管生成和视网膜变性。
图1 PP-TRH-RSV的制备与鉴定:
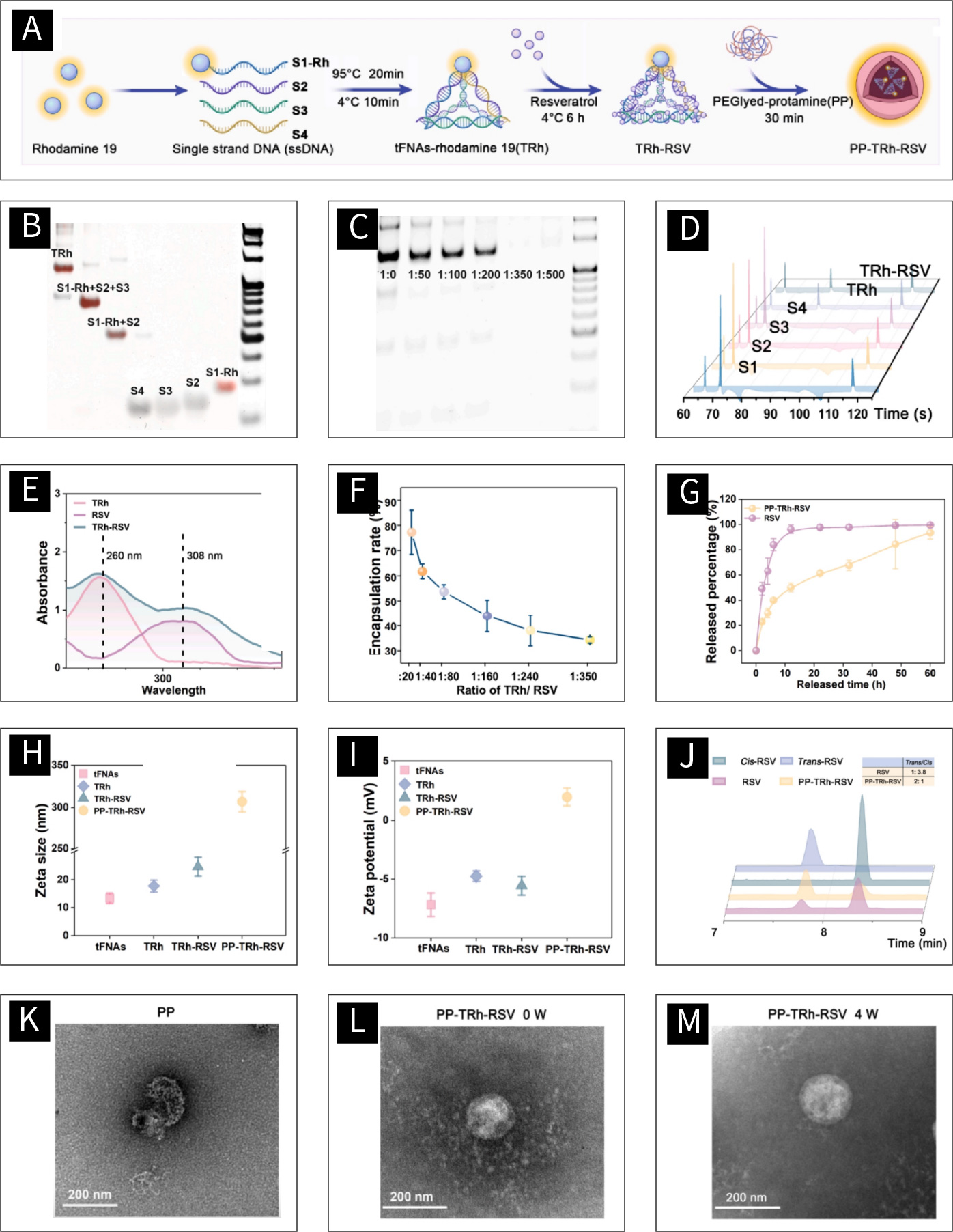
(A)TRh、TRh-RSV和PP-TRh-RSV的合成。(B)Page验证S1-Rh和TRh的制备。(C)不同RSV与TRh比例下的GelRed竞争实验。(D)CGE验证TRh和TRh-RSV的制备。(E)TRh、RSV和TRh-RSV吸收光谱。(F)不同比例TRh对RSV的包封率。(G)RSV和PP-TRh-RSV释放效率。(H) tFNAs、TRh、TRh-RSV和PP-TRh-RSV的Zeta大小。(I) tFNAs、TRh、TRh-RSV和PP-TRh-RSV的Zeta电位。(J)标准顺式RSV、标准反式RSV、自然光处理RSV和自然光处理PP-TRh-RSV HPLC曲线。(K-M)PP-TRh-RSV形态学特征。
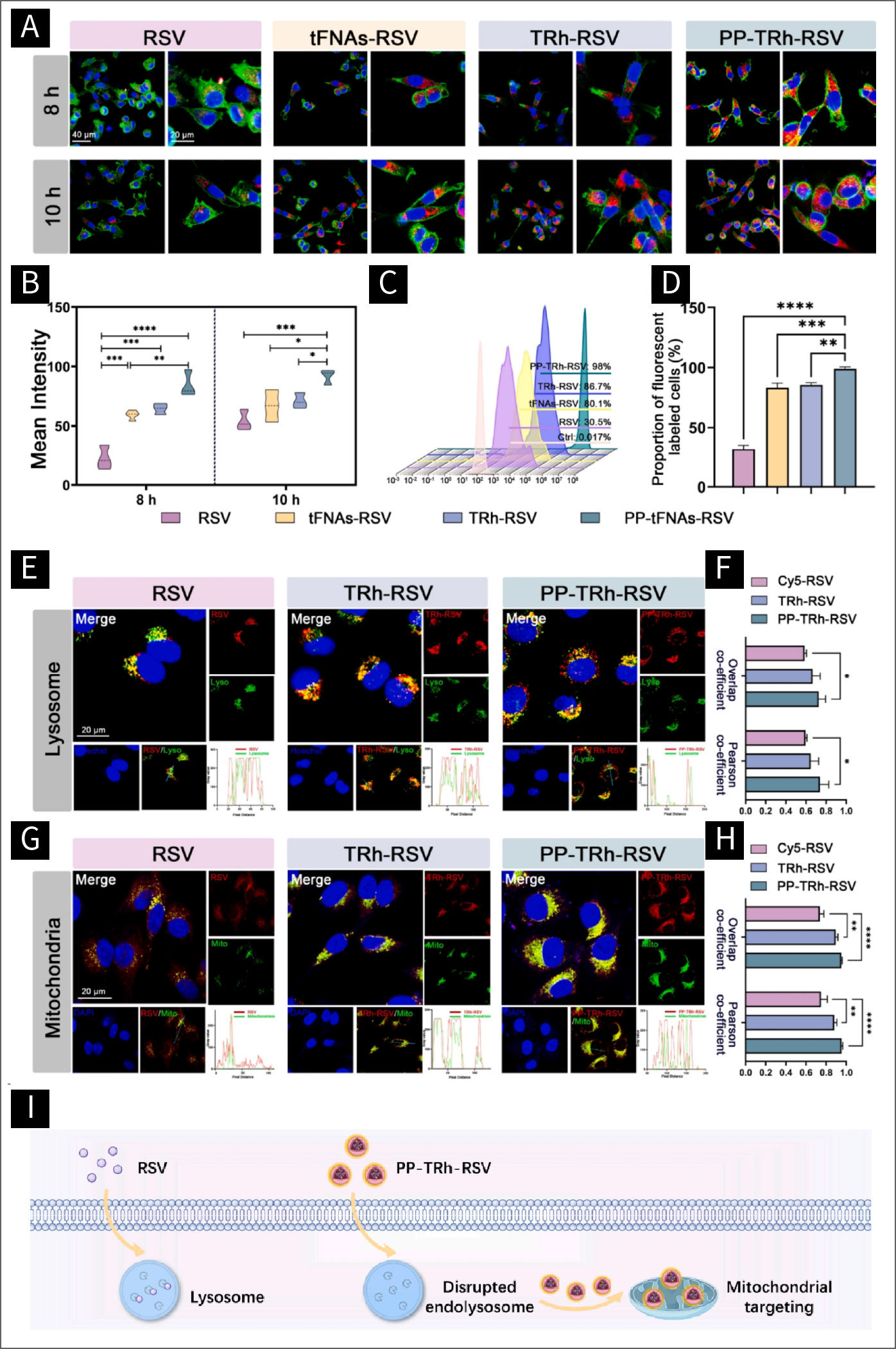
图2 PP-TRh-RSV的溶酶体逃逸和线粒体靶向:
(A)使用Cy5-RSV、Cy5-tFNAs-RSV、Cy5-trh-RSV和Cy5-pp-trh-RSV孵育8 h和10 h的HUVECs代表性免疫荧光图像。(B)不同组Cy5荧光强度的统计分析结果。(C)与Cy5-RSV、Cy5-tFNAs-RSV、Cy5-trh-RSV、Cy5-pp-trh-RSV孵育10 h的HUVECs流式细胞术检测。(D)不同组Cy5标记部分细胞的统计分析结果。(E)与Cy5-RSV、TRh-RSV和PP-TRh-RSV孵育10 h后用LysoTracker和Hoechst染色的HUVECs代表性免疫荧光图像。(F) pearson系数和重叠系数的统计分析结果。(G)Cy5-RSV、TRh-RSV和PP-TRh-RSV孵育10 h后用MitoTracker和DAPI染色的HUVECs代表性免疫荧光图像。(H) pearson系数和重叠系数的统计分析结果de。(I)PP-TRh-RSV的溶酶体逃逸和线粒体靶向作用。
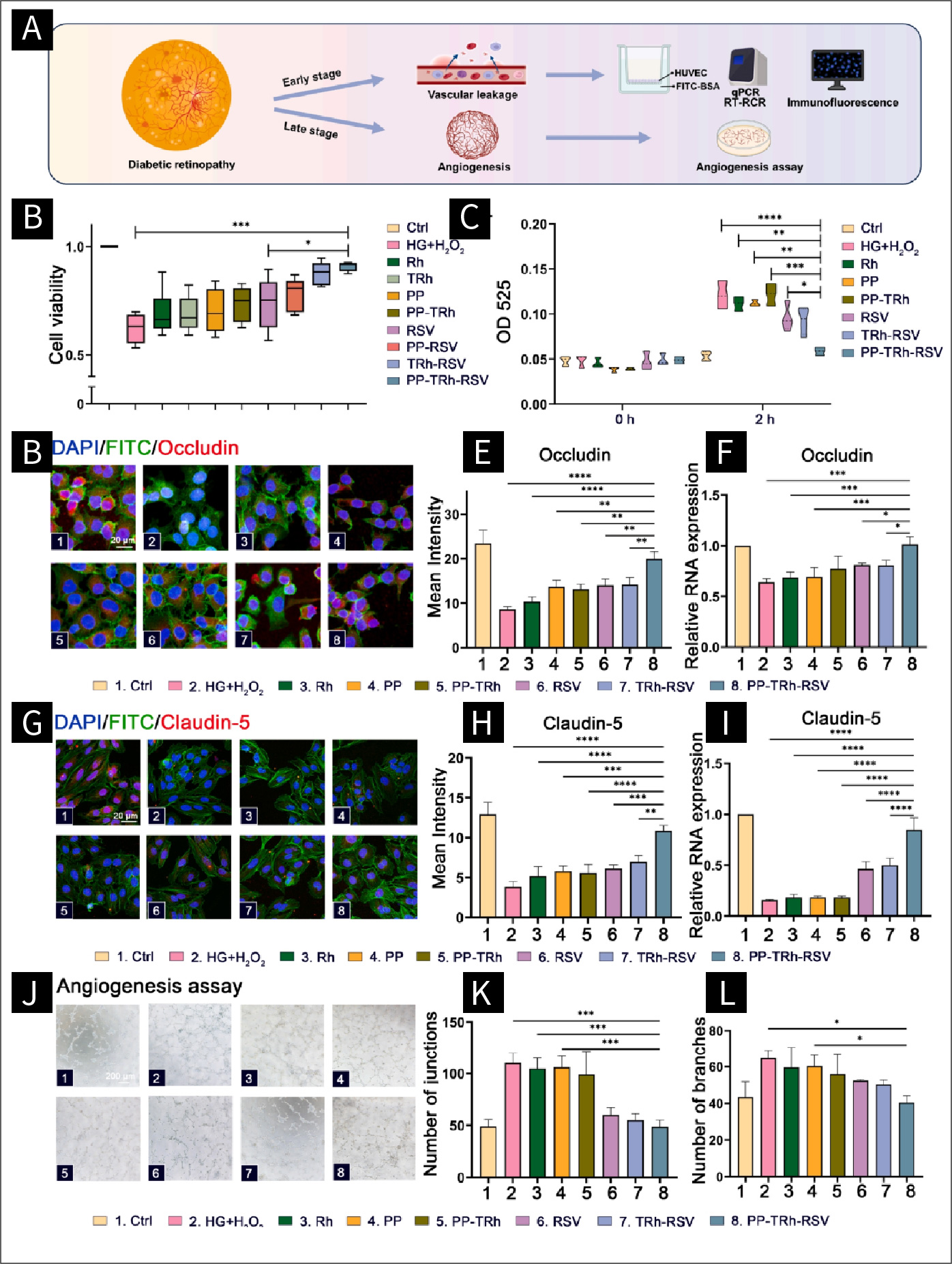
图3 氧化损伤HUVECs血管渗漏和血管生成的调控:
(A)DR早期和后期的表现及检测方法。(B) CCK8法检测葡萄糖和H2O2、Rh、TRh、PP、PP-TRh、RSV、PP-RSV、TRh-RSV和PP-TRh-RSV作用下的细胞活力。(C) HUVECs Transwell检测的统计分析。(D) HUVECs中Occludin的代表性免疫荧光图像。(E) Occludin荧光统计分析。(F) Occludin RNA表达的统计分析。(G) HUVECs中Claudin-5的代表性免疫荧光图像。(H) Claudin-5荧光的统计分析。(I) Claudin-5 RNA表达的统计分析。(J) HUVECs血管生成实验图像。(K)结点数统计分析。(L)分支数统计分析。
图4 HUVECs线粒体氧化还原和线粒体自噬的调控:
(A)HUVECs线粒体的TEM图像(红色箭头:肿胀的线粒体,绿色箭头:完整的线粒体)。(B)肿胀/完整线粒体比例的统计分析。(C) HUVECs的ROS检测。(D) HUVECs中Occludin的代表性免疫荧光图像。(E) HUVECs中MitoSOX的代表性免疫荧光图像。(F) MitoSOX荧光的统计分析。(G) HUVECs中LC3和线粒体的代表性免疫荧光图像。(H) pearson统计分析。(I) HUVECs中PINK1的代表性免疫荧光图像。(J) PINK1荧光的统计分析。(K) PINK1 RNA表达的统计分析。
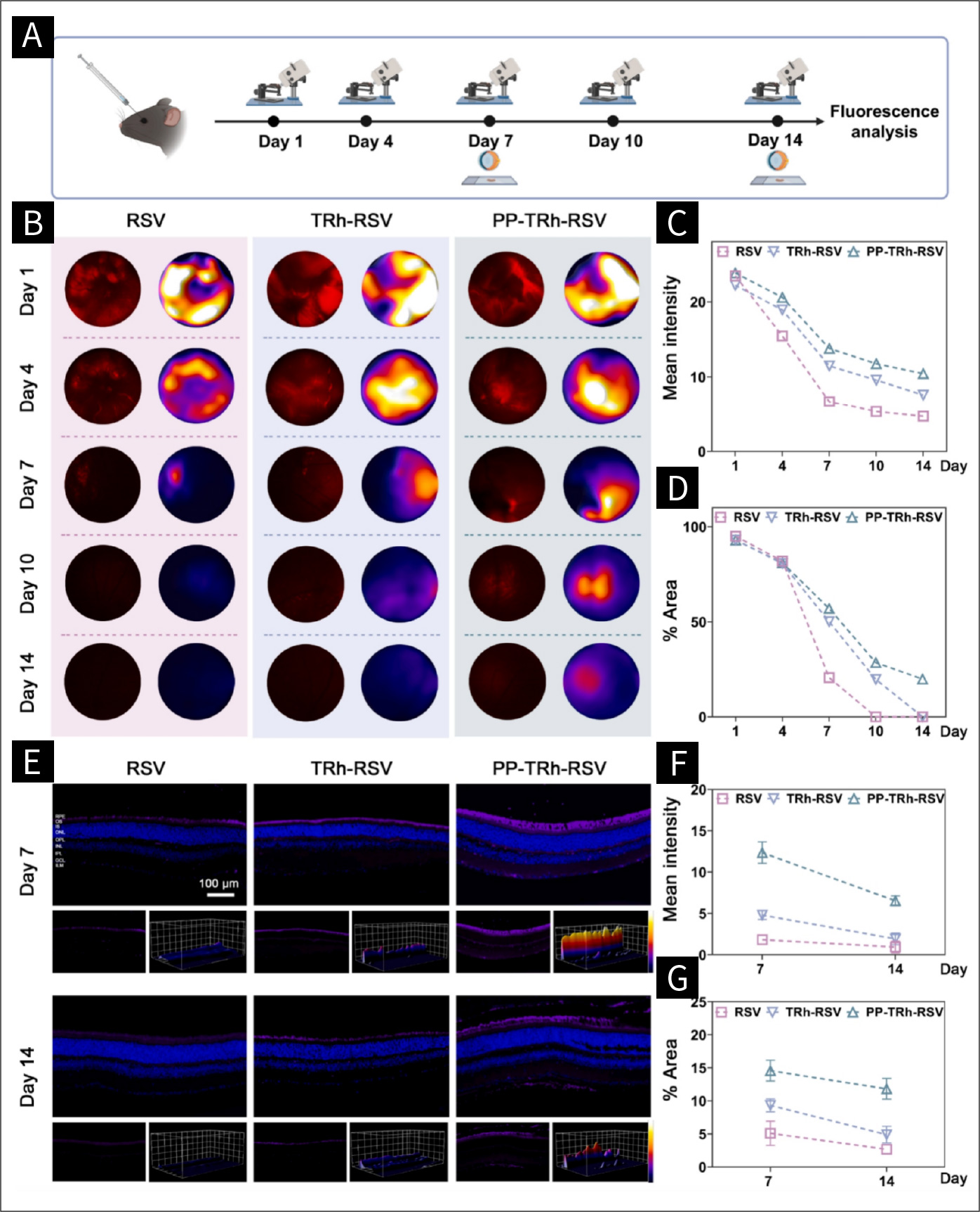
图5 用于玻璃体内注射的可追踪纳米系统:
(A)动物实验中药物分布和代谢的测量示意图。(B) FFA检测RSV、TRh-RSV和PP-TRh-RSV在不同时间点的分布。(C) FFA平均强度的统计分析。(D) FFA荧光面积百分比统计分析。(E) RSV、TRh-RSV和PP-TRh-RSV在不同时间点的代表性切片图像。(F)切片分析平均强度的统计分析。(G)切片图像荧光面积百分比统计分析。
图6 dr微血管生成和视网膜变性的改善:
(A)动物实验中微血管生成和视网膜变性的评价示意图。(B) FFA在不同时间点视网膜血管荧光强度。(C)视网膜血管百分比面积统计分析。(D)视网膜血管连接总数统计分析。(E) 24周龄不同方向OCT图像。(F)水平轴视网膜厚度统计分析。(G)纵轴视网膜厚度统计分析。(H) 24周龄HE染色图像。(I) 24周龄视网膜斑块和PAS染色图像。(J)内皮细胞的统计分析。(L)血管百分比面积统计分析。(M)血管总长度统计分析。
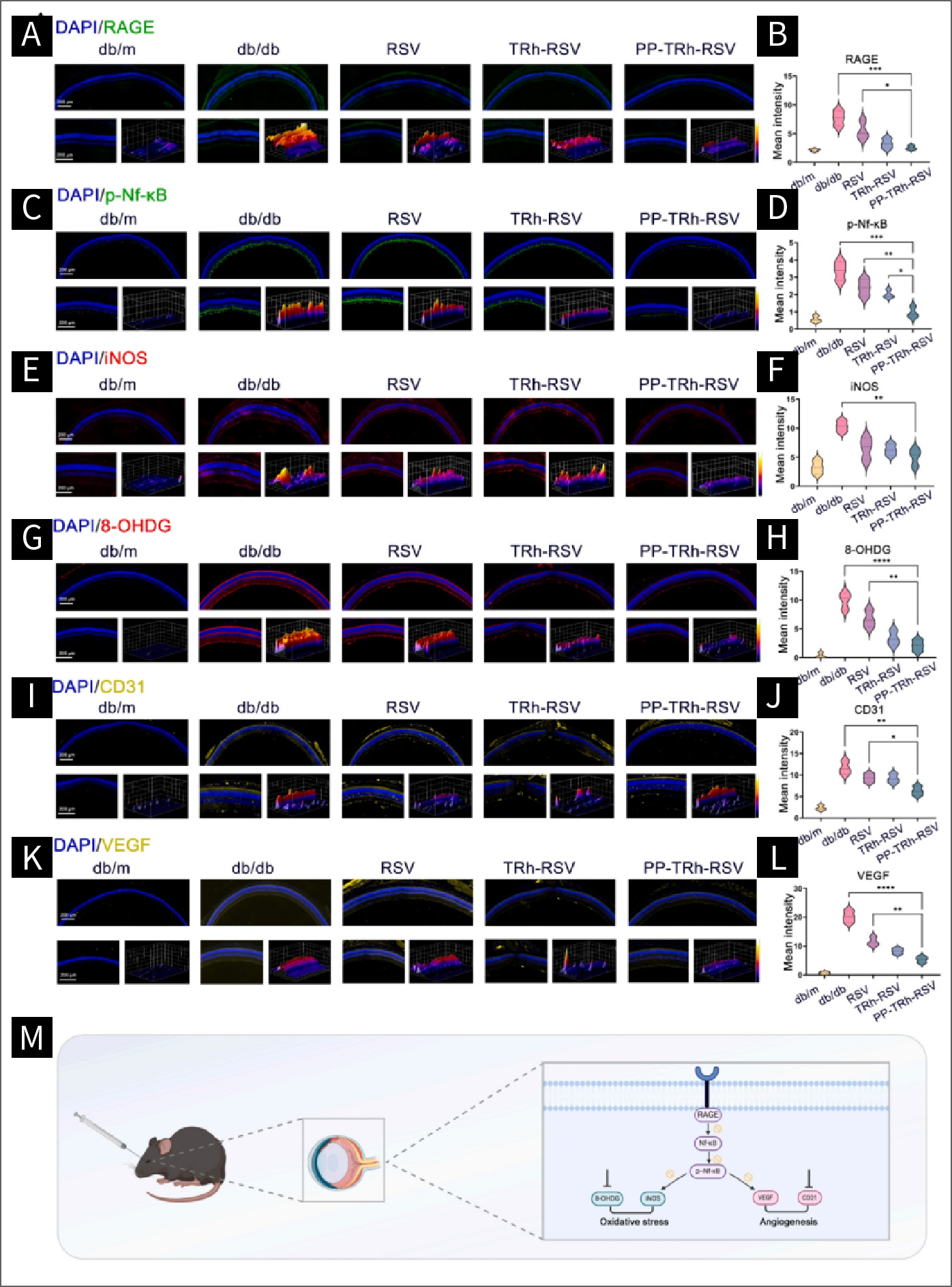
图7 DR中RAGE/NF-κB/iNOS和RAGE/NF-κB/VEGF通路下调:
(A)视网膜中RAGE表达的代表性免疫荧光图像。(B)RAGE荧光的统计分析。(C)视网膜p-Nf-κB p65表达的代表性免疫荧光图像。(D)p-Nf-κB p65荧光的统计分析。(E)视网膜iNOS表达的代表性免疫荧光图像。(F)iNOS荧光统计分析。(G)视网膜中8-OHDG表达的代表性免疫荧光图像。(H)8-OHDG荧光统计分析。(I)视网膜中CD31表达的代表性免疫荧光图像。(J) CD31荧光的统计分析。(K)视网膜中VEGF表达的代表性免疫荧光图像。(L) VEGF荧光统计分析。
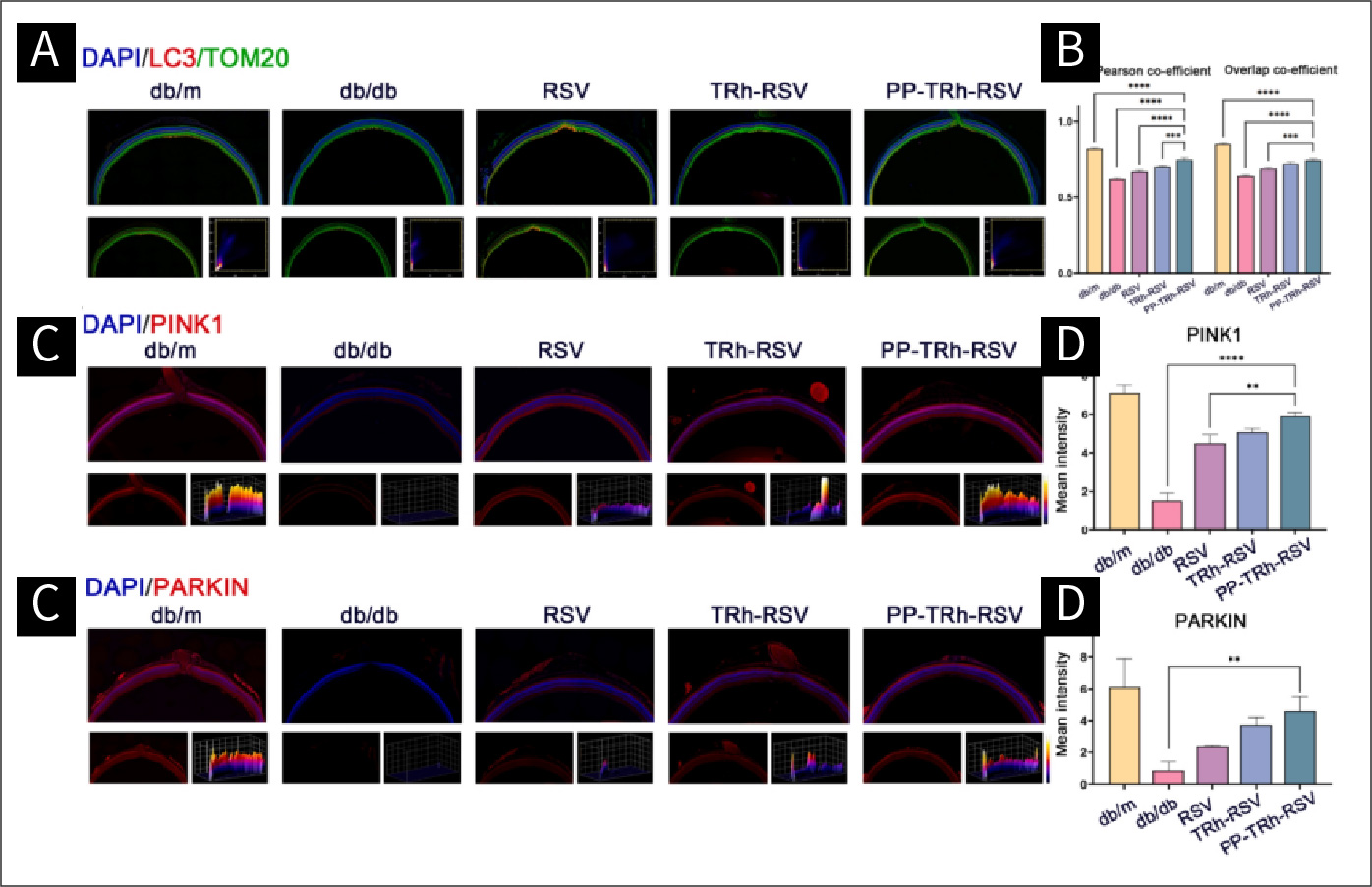
图8 DR中线粒体的调控:
(A)视网膜LC3和线粒体(TOM20标记)的代表性免疫荧光图像。(B) pearson和重叠系数的统计分析。(C)视网膜中PINK1的代表性免疫荧光图像。(D)PINK1荧光的统计分析。(E)视网膜中PARKIN的代表性免疫荧光图像。(F) PARKIN荧光的统计分析。
作者合成了一个可追踪的线粒体靶向纳米系统。该纳米体系不仅具有理想的生物相容性和生物利用度,而且保证了RSV的连续释放和光化学稳定性。在体外,PP-TRh-RSV有效地从内溶酶体中逃逸,靶向线粒体,调节氧化还原稳态,并调节线粒体自噬。它还能减轻体外DR模型的血管渗漏和血管新生。在体内,PP-TRh-RSV可通过临床眼科激光诊断装置检测和监测。PP-TRh-RSV通过调节RAGE/Nf-κB/iNOS和RAGE/Nf-κB/VEGF通路,抑制视网膜新生血管和视网膜退化,延缓DR的疾病进展。该研究可能通过线粒体靶向治疗和线粒体自噬和氧化还原平衡的协调调节,为解决其他糖尿病微血管病变提供新的途径。